Etanol
| Tomuto článku alebo sekcii chýbajú odkazy na spoľahlivé zdroje, môže preto obsahovať informácie, ktoré je potrebné ešte overiť. Pomôžte Wikipédii a doplňte do článku citácie, odkazy na spoľahlivé zdroje. |
| Etanol (bezvodý) | |||||||||||||||
 | |||||||||||||||
 | |||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||
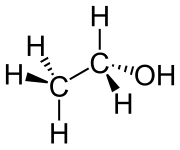
| Sumárny vzorec | C2H6O | ||||||||||||||
| Synonymá |
| ||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||
| Molekulová hmotnosť | 46,07 g/mol | ||||||||||||||
| Teplota topenia | −114,4 °C | ||||||||||||||
| Teplota varu | 78,3 °C (1013 hPa) | ||||||||||||||
| Hustota | 0,789 g/cm3 | ||||||||||||||
| Teplota vzplanutia | 13 °C (5 % vody) 24 °C (50 % vody) | ||||||||||||||
| Medze výbušnosti | 3,4–15 % objemových | ||||||||||||||
| |||||||||||||||
| Ďalšie informácie | |||||||||||||||
| Číslo CAS | 64-17-5 | ||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||

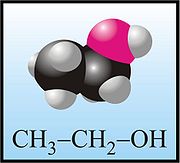
Etanol (iné názvy: etylalkohol, alkohol, lieh) je bezfarebná horľavá kvapalina s charakteristickým zápachom patriaca medzi silné narkotiká. Jej požitie najprv vyvoláva povzbudenie a neskôr paralýzu nervového systému. Jej chemický vzorec je CH3-CH2-OH, často sa uvádza aj ako C2H5OH, sumárne C2H6O.
Príprava
[upraviť | upraviť zdroj]Najväčšia časť produkcie etanolu sa pripravuje z jednoduchých sacharidov (cukrov) alkoholickým kvasením pôsobením rôznych druhov kvasiniek, predovšetkým rôzných šľachtených kmeňových druhov Saccharomyces cerevisiae. Používa sa k tomu ako cukrový roztok (o maximálnej koncentrácii 20 %), tak aj priamo prírodné suroviny obsahujúce sacharidy, ako sú napr. zemiaky alebo cukrová trstina. Kvasný proces prebieha podľa sumárnej rovnice
- C6H12O6 → 2 C2H5OH + 2 CO2.
Kvalita takto získaného etanolu je veľmi závislá na východiskovej surovine; kvasením vzniká zápara, čiže veľmi zriedený vodný roztok etanolu (maximálne 15 %); vždy však obsahuje nežiaduce prímesi, zrejme vyššie alkoholy (propanol a izopropanol), viac sýtené alkoholy (glycerol), ketóny (acetón) aj. Čistenie sa uskutočňuje na výkonných destilačných kolónach, pričom možno získať tzv. azeotropný alkohol, obsahujúci 95,57 % etanolu a 4,43 % vody. Zvyšok vody môžeme odstrániť destiláciou s bezvodným síranom vápenatým alebo oxidom vápenatým, ktoré vodu viažu alebo dlhodobým pôsobením hygroskopických látok ako napr. bezvodného uhličitanu draselného alebo bezvodného síranu meďnatého (modrej skalice), prípadne molekulových sít. Týmito postupmi možno získať etanol o čistote až 99,9 % (tzv. absolútny alkohol alebo bezvodý etanol, obsahujúci menej nez 0,5 % vody a viac než 99,5 % etanolu). Inou metódou získavania bezvodého etanolu je tzv. azeotropická metóda, spočívajúca v destilácii s prídavkom benzínu alebo benzénu, ktorou môžeme získať produkt o čistote až 99,7 %.
Synteticky sa etanol pripravuje katalytickou hydratáciou eténu (etylénu)
- CH2=CH2 + H2O → C2H5OH
Ako katalyzátor sa používa kyselina trihydrogenfosforečná na oxide kremičitom. Takto pripravený etanol má oveľa menej nečistôt než kvasený a je preto kvalitnejší.
Ďalší spôsob syntetickej prípravy spočíva v katalytickej hydrogenácii acetaldehydu, ktorý môže byť priemyselne vyrábaný hydratáciou acetylénu
- HC≡CH + H2 + H2O → CH3–CHO
- CH3–CHO + H2 → CH3–CH2OH
Chemické reakcie etanolu
[upraviť | upraviť zdroj]Samotný etanol je látka pomerne reaktívna, zvlášť búrlivo reaguje s alkalickými kovmi (sodíkom alebo draslíkom). Všeobecná schéma reakcie etanolu s kovom:
etanol + kov → etoxid (etanolát) + vodík.
Reakcia etanolu so sodíkom prebieha nasledujúcim spôsobom:
2 C2H5OH + 2 Na → 2 C2H5ONa + H2.
Produktom tejto reakcie je unikajúci vodík a etoxid sodný (etanolát sodný). Pri reakcii s draslíkom by analogicky vznikol etoxid draselný..
Etoxidy sú veľmi bázické a pôsobením vody sa rozkladajú späť na etanol a hydroxid príslušného alkalického kovu, napr.
C2H5ONa + H2O → C2H5OH + NaOH.
Pôsobením oxidačných činidiel (napr. manganistanu draselného) sa etanol oxiduje najskôr na acetaldehyd, ktorý sa môže ďalej oxidovať na kyselinu octovú.
2 CH3CH2OH + O2 → 2 CH3CH=O + 2 H2O
CH3CH=O + O → CH3COOH.
Premena etanolu na kyselinu octovú prebieha tiež pôsobením mikroorganizmov, hlavne rodu Acetobacter (tzv. octové kvasenie, napr. pri výrobe octu z vína). Postupná oxidácia etanolu je tiež podstatou jeho odbúravania z tela po jeho konzumácii. Priama reakcia s kyslíkom môže prebiehať ako horenie, pri ktorom sa etanol oxiduje až na oxid uhličitý a vodu. Ide o veľmi exotermickú reakciu.
CH3CH2OH + 3 O2 → 2 CO2 + 3 H2O.
Pôsobením halogénvodíkov na etanol dochádza k náhrade hydroxylovej skupiny príslušným halogénovým atómom; napr. účinkom bromovodíku vzniká brometán (etylbromid). Táto reakcia môže prebiehať buď priamo
C2H5OH + HBr → C2H5Br + H2O,
alebo pôsobením zmesi bromidu draselného a koncentrovanej kyseliny sírovej
C2H5OH + KBr + H2SO4 → C2H5Br + H2O + KHSO4.
Uvedená reakcia však nemusí končiť vznikom etylbromidu, pretože ten môže reagovať s ďalšou molekulou etanolu za vzniku dietyléteru
C2H5Br + C2H5OH → CH3CH2–O–CH2CH3 + HBr.
Podobne vzniká dietyléter aj pôsobením iných silných anorganických kyselín, napr. kyseliny sírovej, kyseliny fosforečnej, kyseliny chlorovodíkovej alebo niektorých hydrogénsolí, ako hydrogénsíranu draselného atď.
Pôsobením halogenidov karboxylových kyselín na etanol vznikajú estery etanolu a príslušnej organickej kyseliny. Napr. reakciou s acetylchloridom (chloridom kyseliny octovej) vzniká etylacetát (octan etylnatý)
C2H5OH + CH3COCl → CH3COCH2CH3 + HCl.
Estery etanolu môžu vznikať aj priamou reakciou s karboxylovými kyselinami za prítomnosti kyseliny sírovej, ktorá viaže vznikajúci vodu
C2H5OH + CH3COOH → CH3COOCH2CH3 + H2O.
Za prítomnosti niklových katalyzátorov a zvýšenej teploty 150-220 °C vzniká zmes etylamínov
CH3CH2OH + NH3 → CH3CH2NH2 + H2O ,
CH3CH2OH + CH3CH2NH2 → (CH3CH2)2NH + H2O,
CH3CH2OH + (CH3CH2)2NH → (CH3CH2) 3N + H2O.
Katalytickým odštiepením molekuly vody z etanolu vzniká najjednoduchší alkén (olefín), etén (etylén)
CH3–CH2OH → CH2=CH2 + H2O.
Použitie
[upraviť | upraviť zdroj]Najznámejším použitím etanolu je výroba alkoholických nápojov. Na výrobu kvalitných destilátov (whisky, slivovica,calvados, jablkovica, hruškovica a iné) sa uprednostňuje dvojstupňová destilácia, kde obsah etanolu nebýva vyšší ako 70 %. Tiež sa používa pre zlepšenie výkonu spaľovacích motorov ako prídavok do pohonných hmôt. V medicíne sa používa ako rozpúšťadlo (napr. jódu, tým vzniká tzv. jódová tinktúra), pri príprave niektorých kvapalných prípravkov pre vnútorné a vonkajšie použitie (pri požití je potrebná opatrnosť a bezprostredne po ňom sa neodporúča riadiť motorové vozidlá) a k dezinfekcii neporanenej kože. V oblasti kozmetiky sa uplatňuje pri výrobe voňaviek. Tento alkohol má svoje miesto aj pri výrobe čistiacich prostriedkov, napr. Okeny.
V chemickom priemysle sa používa ako surovina, najmä pri výrobe ďalších organických zlúčenín:
Etanol ako palivo
[upraviť | upraviť zdroj]Etanol je vysoko hodnotné ekologické palivo pre spaľovacie motory. Má antidetonačné vlastnosti. Jeho nedostatkom je schopnosť viazať vodu a pôsobiť tak na koróziu motoru, čo je možné odstrániť pridaním vhodných aditív (antikoróznych prípravkov).
Denaturácia etanolu
[upraviť | upraviť zdroj]Etanol určený pre iné použitie ako na priamu konzumáciu, príp. na výrobu alkoholických nápojov, sa denaturuje (doslova sa pozbavuje prirodzených vlastností). Dôvody sú ekonomicko-právne: na konzumný etanol je na Slovensku (podobne, ako v mnohých iných štátoch) uvalená vysoká spotrebná daň, preto sa do etanolu predávaného na technické účely pridávajú pre človeka toxické látky, aby sa tak mohla obísť spotrebná daň. Etanol sa väčšinou denaturuje metanolom, benzínom, benzénom, izopropanolom, acetónom a inými látkami v závislosti na cieľovom použití. Spotrebná daň z liehu je v súčasnosti na úrovni 1 080 eur v základnej a 540 eur v zníženej sadzbe na hektoliter prepočítaného 100 % etanolu. Povinnosti súvisiace s denaturovaním liehu upravuje v súčasnosti zákon č. 530/2011 Z.z. o spotrebnej dani z alkoholických nápojov v znení neskorších predpisov. Na Slovensku povolené denaturačné prostriedky určené na osobitnú denaturáciu liehu a zmesi denaturačných prostriedkov určených na úplnú denaturáciu liehu upravuje vyhláška Ministerstva financií SR č. 538/2011 Z. z. o povolených denaturačných prostriedkoch, ich ustanovených množstvách na denaturáciu liehu, o požiadavkách na denaturáciu liehu a manipuláciu s denaturovaným liehom, o požiadavkách na jeho vlastnosti a o určenom účele použitia denaturovaného liehu.
Iné projekty
[upraviť | upraviť zdroj] Commons ponúka multimediálne súbory na tému Etanol
Commons ponúka multimediálne súbory na tému Etanol



