Antracen

| |

| |
| Imena | |
|---|---|
| IUPAC ime
antracen
| |
| Identifikatorji | |
3D model (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.003.974 |
| KEGG | |
PubChem CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Lastnosti | |
| C14H10 | |
| Molska masa | 178,23 g·mol−1 |
| Videz | brezbarven |
| Gostota | 1,25 g/cm³ pri 19,85 °C, trden 0,969 g/cm³ pri 220 °C, tekoč |
| Tališče | 218 °C (424 °F; 491 K) |
| Vrelišče | 340 °C (644 °F; 613 K) |
| Topnost (druga topila) | voda: netopen metanol: 0,908 g/l heksan: 1,64 g/l |
| Nevarnosti | |
EU klasifikacija (DSD) (zastarelo)
|
|
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |
| Sklici infopolja | |
Antracen je eden trdnih poliaromatskih ogljikovodikov (PAH), sestavljen iz treh taljenih benzenovih obročev. Pojavlja se kot sestavina premogovega katrana. Antracen se uporablja pri proizvodnji rdeče barvanih alizarinov in ostalih barvil. Antracen je brezbarven, pod ultravijolično lučjo je viden modro (z vrhom od 400–500 nm) fluorescentno.
Leta 2010 so v liniji pogleda na zvezdo v odprti zvezdni kopici IC 348 opazili močan absorpcijski pas antracena, kar bi lahko bilo povezano z vmesnim molekularnim oblakom.[2]
Pridobivanje
[uredi | uredi kodo]Gospodarski antracen je pridobljen iz premogovega katrana, pri čemer so skupne nečistoče fenantren in karbazol. Klasična laboratorijska metoda za pripravo antracena poteka s ciklodehidracijo z o-metilom ali o-metilenom substituiranih diarilketona v tako imenovani Elbsovi reakciji.
Reakcije
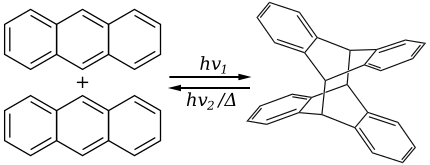
[uredi | uredi kodo]Antracen pod UV-svetlobo fotodimerzira:
Ta dimer je povezan s parom novonastalih vezi C–C, ki so rezultat [4+4] cikloadicije. Dimer se povrne v antracen pod vplivom toplote ali UV-sevanja z valovno dolžino pod 300 nm. Povratna dimerizacija in fotokromične lastnosti antracena so osnova možnim aplikacijam. Substituirani antracenovi derivati se obnašajo podobno. Na reakcijo vpliva prisotnost kisika.
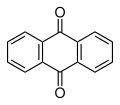
Z redukcijo antracena v glavnem nastane 9,10-dihidroantracen (z uničenjem aromatičnosti osrednjega obroča), namesto 1,4-dihidroantracena (kar bi uničilo aromatičnost enega od stranskih obročev). Prednostna redukcija na položajih 9 in 10 poziciji je razložljiva na podlagi dejstva, da je aromatična stabilizacija energije neposredno povezana s številom konjugiranih vezi π v aromatičnem sistemu. Ker 9,10-dihidroantracen v bistvu ohranja dva benzenska obroča (6 konjugiranih vezi π), 1,4-izomer pa ohranja samo poldrugi obroč (skupno 5 vezi π). Slednji ni termodinamično ugoden produkt. Prav tako velja, da elektrofilna substitucija poteče na položajih 9 in 10, na osrednjem obroču. Oksidacija poteče takoj, nastane pa antrakinon, C14H8O2 (spodaj), na primer z uporabo vodikovega peroksida in vanadil acetilacetonata.
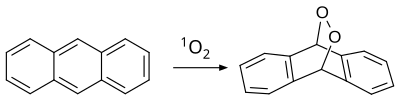
Antracen reagira tudi s singletnim dienofilnim kisikom; poteče [4+2] cikloadicija (Diels-Alderjeva reakcija):
Uporaba
[uredi | uredi kodo]Antracen se največkrat uporablja za pridobivanje antrokinona, ki velja za predhodnika barvil.[3] Antracen je organski polprevodnik. Uporablja se kot scintilator v detektorjih visoko energetskih fotonov, elektronov in delcev alfa. Uporabljajo se tudi scintilatorji, pridobljeni z dopiranjem antracena in umetnih mas, kot je poliviniltoluen. Emisijski spekter antracena pokaže vrh med 400 in 440 nm. Uporablja se tudi v lesnih konzervansih, insekticidih in prevlečnih materialih.
Antracen je ena od treh sestavin (ostali dve sta kalijev perklorat in žveplo), ki se uporabljajo pri ustvarjanju črnega dima, ki se izpušča med papeškim konklavom.[4]
Derivati
[uredi | uredi kodo]Številni derivati antracena se uporabljajo za specifične namene. Derivati s hidroksilno skupino, 1-hidroksiantracen in 2-hidroksiantracen, so homologni fenolu in naftolom in so farmakološko aktivni. Poznani so tudi derivati z več hidroksilnimi skupinami, na primer 9,10-dihidroksiantracenu.
Toksikologija
[uredi | uredi kodo]
V nasprotju z mnogimi drugimi policikličnimi aromatskimi ogljikovodiki (PAH), antracen po seznamu OSHA ni klasificiran kot rakotvorna snov. Antracen, kot mnogi drugi ogljikovodiki, nastaja med procesom gorenja: človek mu je izpostavljen predvsem s tobačnim dimom in uživanjem hrane, ki vsebuje produkte zgorevanja.
Sklici
[uredi | uredi kodo]- ↑ NIST Chemistry WebBook Anthracene
- ↑ Iglesias-Groth, S.; Manchado, A.; Rebolo, R.; Gonzalez Hernandez, J.I.; Garcia-Hernandez, D.A.; Lambert, D.L. (Maj 2010). »A search for interstellar anthracene toward the Perseus anomalous microwave emission region«. arXiv:1005.4388. Bibcode:2010MNRAS.407.2157I. doi:10.1111/j.1365-2966.2010.17075.x.
{{navedi časopis}}: Sklic journal potrebuje|journal=(pomoč) - ↑ Gerd Collin, Hartmut Höke and Jörg Talbiersky "Anthracene" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2006.
- ↑ Vatican Radio, Briefing by Fr. Federico Lombardi, 03/13/2013, 1 p.m. CET.