Phenylalanin
| Phenylalanin | |
|---|---|
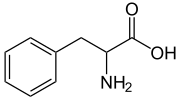 Skeletal formula | |
 Ball-and-stick model | |
| Danh pháp IUPAC | Phenylalanine |
| Tên khác | 2-Amino-3-phenylpropanoic acid |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| DrugBank | DB00120 |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| UNII | |
| Thuộc tính | |
| Điểm nóng chảy | |
| Điểm sôi | |
| Độ axit (pKa) | 1.83 (carboxyl), 9.13 (amino)[1] |
| Các nguy hiểm | |
| NFPA 704 |
|
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Phenylalanin (viết tắt là Phe hoặc F)[2] là một α-amino acid với công thức hóa học C6H5CH2CH(NH2)COOH. Nó là một amino acid thiết yếu không phân cực do nhánh benzyl có tính kị nước.L-Phenylalanin (LPA) là một amino acid trung hòa về điện, là một trong 20 amino acid sinh protein được mã hóa bởi DNA. Các codon của L-phenylalanin là UUU và UUX. Phenylalanin là tiền chất của tyrosin, dopamin, norepinephrin (noradrenalin), epinephrin (adrenalin), và sắc tố của da melanin.
Phenylalanin được tìm thấy trong sữa của động vật có vú. Nó được cho thêm vào thức ăn, đồ uống và thực phẩm bổ sung do nó có tính giảm đau và chống trầm cảm. Nó là tiền chất của chất điều biến thần kinh (neuromodulator) phenylethylamin, một chất thường được cho vào thực phẩm bổ sung.
Vai trò sinh học
[sửa | sửa mã nguồn]L-Phenylalanin được chuyển hóa thành L-tyrosin, một amino acid cũng được mã hóa bởi DNA.L-Tyrosin được chuyển hóa thành L-DOPA, rồi sau đó thành dopamin, norepinephrin (noradrenalin), và epinephrin (adrenalin). Ba chất sau cùng được gọi là các catecholamin.
Phenylalanin vượt qua hàng rào máu-não nhờ kênh vận chuyển chủ động giống với tryptophan. Với một lượng lớn, phenylalanin ảnh hưởng lên sự tổng hợp của serotonin.
Trong thực vật
[sửa | sửa mã nguồn]Phenylalanin là hợp chất đầu tiên trong sinh tổng hợp flavonoid. Lignan là một dẫn xuất của phenylalanin và của tyrosin. Phenylalanin được chuyển hóa thành axit cinnamic nhờ enzyme phenylalanine ammonia-lyase.[3]
Bệnh phenylceton niệu
[sửa | sửa mã nguồn]Bệnh phenylceton niệu (phenylketonuria - PKU) là rối loạn di truyền gây mất chức năng chuyển hóa phenylalanin. Người bị bênh này phải kiểm soát lượng phenylalanin trong thức ăn được đưa vào để ngăn ngừa sự tích tụ của phenylceton trong cơ thể. Một dạng hiếm của bệnh này là bệnh tăng phenylalanin máu do bị mất chức năng tổng hợp một coenzym là biopterin. Phụ nữ mang thai bị bệnh tăng phenylalanin máu sẽ có triệu chứng tăng phenylalanin trong máu nhưng triệu chứng này thường mất đi ở cuối kì mang thai.
Xét nghiệm máu thường được dùng để kiếm soát lượng phenylalanin trong máu của người bị bệnh phenylceton niệu. Kết quả được đưa ra ở hai dạng đơn vị mg/dL và umol/L. Một mg/dL của phenylalanin gần bằng 60 umol/L.
Phenylalanin có trong chất làm ngọt aspartame. Chất này được chuyển hóa trong cơ thể tạo ra nhiều chất, trong đó có phenylalanin. Do đó chất này cũng có ảnh hưởng đến người bị PKU, mặc dù sự ảnh hưởng của nó ít hơn so với lượng proten ăn vào. Tất cả các sản phẩm có chứa aspartame ở Úc, Mĩ và Canada đều được dán nhãn "Chứa aspartame, cẩn thận đối với người bị PKU". Ở Anh, các sản phẩm có chứa aspartame phải được ghi "aspartame" hoặc "E951" trong thành phần cùng với cảnh báo[4]. Các nhà di truyền học gần đây đã nghiên cứu một số gen trong khỉ Macaca và phát hiện thấy trong một số trường hợp, một dạng protein bình thường của khỉ khá giống với dạng protein bệnh lý của người, trong đó có cả dấu hiệu cho thấy bệnh PKU.[5]
D- và DL-phenylalanin
[sửa | sửa mã nguồn]Dạng đồng phân lập thể D-phenylalanin (DPA) có thể được tổng hợp bởi sinh vật dưới dang một đồng phân đối quang riêng rẽ hoặc trong một hỗn hợp racemic. Nó không tham gia vào quá trình sinh tổng hợp protein, mặc dù nó được tìm thấy với một lượng nhỏ trong protein – nhất là các protein để lâu ngày và các thức ăn đã qua xử lý. Chức năng sinh học của các D-amino acid chưa được biết rõ, mặc dù trong đó có một số, kể cả D-phenylalanin, có thể có hoạt tính dược lý.[cần dẫn nguồn] D-Phenylalanin được công nhận là có khả năng ức chế các enzym phân hủy các endorphin, do đó được coi là có tính giảm đau.
DL-Phenylalanin (DLPA) được bán dưới dạng thực phẩm bổ sung do được cho rằng là có tính giảm đau và chống trầm cảm.DL-Phenylalanin là một hỗn hợp của D-Phenylalanin và L-Phenylalanin. Tính giảm đau của DL-phenylalanin có thể được giải thích là do sự ức chế của D-phenylalanin lên tác dụng phân hủy enkephalin (endorphin) của enzym carboxypeptidase A.[6] Tác dụng chống trầm cảm của DL-phenylalanin được cho là do L-phenylalanin có vai trò trong sinh tổng hợp protein để tổng hợp các chất dẫn truyền thần kinh norepinephrin và dopamin. Mức norepinephrin và dopamin cao trong não được cho là có tính chống trầm cảm. Ngoài ra, do DL-phenylalanin ức chế sự phân hủy endorphin, gây ức chế giải phóng GABA ở các nơ-ron mái bụng (ventral tegmental) (nằm trong não giữa), kết quả là sự phóng thích dopamin tăng lên. D-Phenylalanin được hấp thu từ ruột non và vận chuyển đến gan qua hệ tuần hoàn tĩnh mạch cửa. Một lượng nhỏ D-phenylalanin được chuyển hóa thành L-phenylalanin.D-Phenylalanin được phân bố đến các mô khắp cơ thể nhờ hệ tuần hoàn chung. Nó đi qua hàng rào máu-não kém hơn L-phenylalanin, do đó một lượng nhỏ D-phenylalanin được đưa vào qua đường tiêu hóa sẽ được thải ra trong nước tiểu mà không đi qua hệ thần kinh trung ương.
Tổng hợp trong công nghiệp
[sửa | sửa mã nguồn]L-Phenylalanin được tổng hợp để phục vụ cho y khoa, thức ăn chăn nuôi và thực phẩm bổ sung, như aspartame. Một lượng lớn được tổng hợp nhờ vi khuẩn Escherichia coli, do chúng sản sinh ra các amino acid thơm trong đó có phenylalanin. Ngày nay lượng L-phenylalanin tổng hợp được tăng lên do sử dụng kĩ thuật di truyền, bằng cách thay đổi các promoter điều hòa hoặc khuếch đại số lượng các gen mã hóa các enzym tổng hợp amino acid của E. coli.[7]
Lịch sử
[sửa | sửa mã nguồn]Sự mô tả phenylalanin được thực hiện lần đầu vào năm 1879, khi Schulze và Barbieri xác định được công thức thực nghiệm của một hợp chất có trong mầm cây của hạt đậu vàng (Lupinus luteus) là C9H11NO2. Năm 1882, Erlenmeyer và Lipp lần đầu tiên tổng hợp phenylalanin từ phenylacetaldehyde, hydro cyanide, và amonia.[8][9]
Codon của phenylalanin được phát hiện lần đầu tiên bởi J. Heinrich Matthaei và Marshall W. Nirenberg vào năm 1961. Họ đã chứng minh điều đó bằng cách dùng mRNA để chèn các đoạn lặp lại của uracil vào trong gen của vi khuẩn E. coli, làm cho vi khuẩn sản xuất ra một polypeptid chỉ gồm các amino acid phenylalanin được lặp đi lặp lại.
Xem thêm
[sửa | sửa mã nguồn]Tham khảo
[sửa | sửa mã nguồn]- ^ Dawson, R. M. C. (1959). Data for Biochemical Research. Oxford: Clarendon Press.
- ^ IUPAC-IUBMB Joint Commission on Biochemical Nomenclature (1983). “Nomenclature and Symbolism for Amino Acids and Peptides”. Recommendations on Organic & Biochemical Nomenclature, Symbols & Terminology etc. Truy cập ngày 17 tháng 5 năm 2007.
- ^ Nelson, D. L.; Cox, M. M. (2000). Lehninger, Principles of Biochemistry (ấn bản thứ 3). New York: Worth Publishing. ISBN 1-57259-153-6.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- ^ “Aspartame”. UK: Food Standards Agency. Bản gốc lưu trữ ngày 21 tháng 2 năm 2012. Truy cập ngày 13 tháng 8 năm 2012.
- ^ Gibbs, R. A. (2007). “Evolutionary and Biomedical Insights from the Rhesus Macaque Genome” (pdf). Science. 316 (5822): 222–234. doi:10.1126/science.1139247.
- ^ Christianson, D. W.; Mangani, S.; Shoham, G.; Lipscomb, W. N. (1989). “Binding of D-Phenylalanine and D-Tyrosine to Carboxypeptidase A” (pdf). Journal of Biological Chemistry. 264 (22): 12849–12853. PMID 2568989.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- ^ Sprenger, G. A. (2007). “Aromatic Amino Acids”. Amino Acid Biosynthesis: Pathways, Regulation and Metabolic Engineering (ấn bản thứ 1). Springer. tr. 106–113. ISBN 978-3-540-48595-7.Bản mẫu:Inconsistent citations
- ^ Thorpe, T. E. (1913). A Dictionary of Applied Chemistry. Longmans, Green, and Co. tr. 191–193. Truy cập ngày 4 tháng 6 năm 2012.
- ^ Plimmer, R. H. A. (1912) [1908]. Plimmer, R. H. A.; Hopkins, F. G. (biên tập). The Chemical Composition of the Proteins. Monographs on Biochemistry. Part I. Analysis (ấn bản thứ 2). London: Longmans, Green and Co. tr. 93–97. Truy cập ngày 4 tháng 6 năm 2012.Quản lý CS1: nhiều tên: danh sách biên tập viên (liên kết)



