Aromatiese verbinding

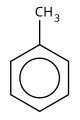
Aromatiese verbindings is die chemiese verbindings (meestal organies) wat een of meer ringe bevat met pi-elektrone wat rondom hulle gedelokaliseer is. In teenstelling met verbindings wat aromatisiteit vertoon, ontbreek alifatiese verbindings hierdie delokalisering. Die term "aromaties" is toegeken voordat die fisiese meganisme wat aromatisiteit bepaal ontdek was en verwys bloot na die feit dat baie sulke verbindings 'n soet of aangename reuk het; nie alle aromatiese verbindings het 'n soet reuk nie, en nie alle verbindings met 'n soet reuk is aromaties nie. Aromatiese koolwaterstowwe, of arene, is aromatiese organiese verbindings wat slegs koolstof- en waterstofatome bevat. Die konfigurasie van ses koolstofatome in aromatiese verbindings word 'n "benseenring" genoem, na die eenvoudige aromatiese verbinding benseen, of 'n "fenielgroep" as dit deel van 'n groter verbinding is.
Nie alle aromatiese verbindings is op benseen gebaseer nie. Aromatisiteit kan ook manifesteer in heteroarene, waar een of meer koolstofatome vervang is deur 'n ander atoom bv. suurstof, stikstof of swawel. In heteroarene wat Hückel se reël volg, dws. vir enkel (monosikliese) ringe, wanneer die aantal π-elektrone daarvan gelyk is aan 4n + 2, waar n = 0, 1, 2, 3, ..., kan dit 'n aromatiese verbinding vorm. Voorbeelde van nie-benseenverbindings met aromatiese eienskappe is furaan, 'n heterosikliese verbinding met 'n vyfledige ring wat 'n enkele suurstofatoom bevat, en piridien, 'n heterosikliese verbinding met 'n sesledige ring wat een stikstofatoom bevat.[1]
Die benseenringmodel
[wysig | wysig bron]
- Hoofartikel: Aromatisiteit
Benseen, C6H6, is die eenvoudigste aromatiese koolwaterstof, en dit was die eerste wat as sodanig benoem is. Die aard van sy binding is die eerste keer in die 19de eeu deur die Duitse organiese chemikus August Kekulé erken. Elke koolstofatoom in die seskantige siklus het vier elektrone om te deel. Een gaan na die waterstofatoom en een na elk van die twee naburige koolstowwe. Dit laat een elektron om met een van die twee naburige koolstofatome te deel, en skep sodoende 'n dubbele binding met een koolstof en laat 'n enkele binding met die ander agter, en daarom vertoon sommige voorstellings van die benzeenmolekule dit as 'n seshoek met alternatiewe enkel en dubbelbindings.
Ander uitbeeldings van die struktuur beeld die seshoek uit met 'n sirkel daarin om aan te dui dat die ses elektrone in gedelokaliseerde molekulêre orbitale, soos die ring self, ronddryf. Dit verteenwoordig die ekwivalente aard van die ses koolstof-koolstofbindings wat almal bindingsvolgorde 1.5 het; die ekwivalensie word verklaar deur resonansievorme. Die elektrone word voorgestel as drywend bo en onder die ring, met die elektromagnetiese velde wat hulle genereer om die ring plat te hou.
Algemene eienskappe van aromatiese koolwaterstowwe:
- Hulle vertoon aromatisiteit
- Die koolstof-waterstofverhouding is hoog
- Hulle brand met 'n sterk roetgeel vlam as gevolg van die hoë koolstof-waterstofverhouding
- Hulle ondergaan elektrofiele substitusiereaksies en nukleofiele aromatiese substitusies
Die sirkelsimbool vir aromatisiteit is in 1925 deur Sir Robert Robinson en sy student, James Armit, bekendgestel[2] en is gewild gemaak in 1959 deur die Morrison & Boyd-handboek oor organiese chemie. Een moontlike inspirasie vir die sirkelsimbool is die ouroboros, of die slang wat sy eie stert vreet.
Areensintese
[wysig | wysig bron]'n Reaksie wat areenverbindings vorm uit onversadigde of gedeeltelik-onversadigde sikliese voorlopers, word eenvoudig "aromatisering" genoem. Daar bestaan baie laboratoriummetodes vir die organiese sintese van arene uit nie-areenvoorgangers. Baie metodes is afhanklik van reaksies van sikliese addisie. Voorbeelde van reaksies is:

- die Wulff–Dötz-reaksie, waarin 'n alkien, koolstofmonoksied en 'n chroomkoolstofkompleks die reaktante is,
- die Diels–Alder-reaksie van alkiene met piroon of siklopentadienoon om areenverbindings te vorm met afskeid van koolstofdioksied of koolstofmonoksied, en
- die Bergman-siklisering waarin die reaktante 'n enien plus 'n waterstofskenker is.
'n Ander stel metodes is die aromatisering van sikloheksane en ander alifatiese ringe: reagense is katalisators wat gebruik word in hydrogenering, soos platinum, palladium en nikkel saam met die elemente swawel en seleen.[3]
Reaksies van aromatiese verbindings
[wysig | wysig bron]
Aromatiese ringstelsels neem deel aan baie organiese reaksies. Die mees algemeen is:
- By aromatiese substitusie word een substituent aan die areen-ring, gewoonlik waterstof, vervang deur 'n ander substituent.
- In koppelingsreaksies kataliseer 'n metaal 'n koppeling tussen fragmente, wat gewoonlik nuwe koolstof-koolstofbindings vorm.
- Hidrogenering van arene veroorsaak in versadigde ringe en verander die aromatiese aard daarvan.
Voorbeelde van aromatiese verbindings
[wysig | wysig bron]- Verteenwoordigende areenverbindings
-
Etielbenseen
-
Mesitileen
-
Dureen
-
2-fenielheksaan
-
Bifeniel
-
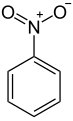
Nitrobenseen
Verwysings
[wysig | wysig bron]- ↑ "Aromatic Compound". Encyclopedia.com (in Engels). 16 Oktober 2020. Besoek op 6 November 2020.
- ↑ Armit, James Wilkins; Robinson, Robert (1925). "Polynuclear heterocyclic aromatic types. Part II. Some anhydronium bases". J. Chem. Soc. Trans. (in Engels). 127: 1604–1618.
- ↑ March, Jerry (1985). Advanced organic chemistry : reactions, mechanisms, and structure (in Engels). New York: Wiley. ISBN 0-471-85472-7. OCLC 10998226.