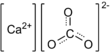ক্যালসিয়াম কার্বনেট
| |||

| |||
| নামসমূহ | |||
|---|---|---|---|
| ইউপ্যাক নাম
Calcium carbonate
| |||
| অন্যান্য নাম | |||
| শনাক্তকারী | |||
ত্রিমাত্রিক মডেল (জেমল)
|
|||
| সিএইচইবিআই | |||
| সিএইচইএমবিএল | |||
| কেমস্পাইডার | |||
| ইসিএইচএ ইনফোকার্ড | ১০০.০০৬.৭৬৫ | ||
| ইসি-নম্বর |
| ||
| ই নম্বর | E১৭০ (রঙ) | ||
| কেইজিজি | |||
পাবকেম CID
|
|||
| আরটিইসিএস নম্বর |
| ||
| ইউএনআইআই | |||
কম্পটক্স ড্যাশবোর্ড (EPA)
|
|||
| |||
| |||
| বৈশিষ্ট্য | |||
| CaCO3 | |||
| আণবিক ভর | 100.0869 g/mol | ||
| বর্ণ | Fine white powder; chalky taste | ||
| গন্ধ | odorless | ||
| ঘনত্ব | 2.711 g/cm3 (calcite) 2.83 g/cm3 (aragonite) | ||
| গলনাঙ্ক | 1,339 °C (2,442 °F; 1,612 K) (calcite) 825 °C (1517 °F; 1,098 K) (aragonite) [১] | ||
| স্ফুটনাঙ্ক | decomposes | ||
| 0.013 g/L (25 °C)[২][৩] | |||
Solubility product (Ksp)
|
4.8×১০−৯[৪] | ||
| দ্রাব্যতা in dilute acids | soluble | ||
| অম্লতা (pKa) | 9.0 | ||
| প্রতিসরাঙ্ক (nD) | 1.59 | ||
| গঠন | |||
| স্ফটিক গঠন | Trigonal | ||
| Space group | 32/m | ||
| তাপ রসায়নবিদ্যা | |||
| স্ট্যন্ডার্ড মোলার এন্ট্রোফি এস |
93 J·mol−1·K−1[৫] | ||
| গঠনে প্রমান এনথ্যাল্পির পরিবর্তন ΔfH |
−1207 kJ·mol−1[৫] | ||
| ঝুঁকি প্রবণতা | |||
| এনএফপিএ ৭০৪ | |||
| ফ্ল্যাশ পয়েন্ট | ৮২৫ °সে (১,৫১৭ °ফা; ১,০৯৮ K) | ||
| প্রাণঘাতী ডোজ বা একাগ্রতা (LD, LC): | |||
LD৫০ (মধ্যমা ডোজ)
|
6450 mg/kg (oral, rat) | ||
| যুক্তরাষ্ট্রের স্বাস্থ্য অনাবৃতকরণ সীমা (NIOSH): | |||
PEL (অনুমোদনযোগ্য)
|
TWA 15 mg/m3 (total) TWA 5 mg/m3 (resp)[৬] | ||
| সম্পর্কিত যৌগ | |||
অন্যান্য অ্যানায়নসমূহ
|
Calcium bicarbonate | ||
অন্যান্য ক্যাটায়নসমূহ
|
Magnesium carbonate Strontium carbonate Barium carbonate | ||
সুনির্দিষ্টভাবে উল্লেখ করা ছাড়া, পদার্থসমূহের সকল তথ্য-উপাত্তসমূহ তাদের প্রমাণ অবস্থা (২৫ °সে (৭৭ °ফা), ১০০ kPa) অনুসারে দেওয়া হয়েছে। | |||
| তথ্যছক তথ্যসূত্র | |||
ক্যালসিয়াম কার্বনেট হলো একটি রাসায়নিক যৌগ যার সংকেত হচ্ছে CaCO3। এটি প্রধানত তিনটি উপাদান কার্বন, অক্সিজেন এবং ক্যালসিয়াম দ্বারা গঠিত। পাথর বা শিলার মধ্যে এটি একটি সাধারণ উপাদান এবং মুক্তা, সামুদ্রিক প্রাণীর খোলস,শামুক,ডিমের খোসা ইত্যাদির প্রধান উপাদান। কৃষিজ চুনায় এটি একটি সক্রিয় উপাদান,যা ক্যালসিয়াম আয়ন ও জলের সাথে বিক্রিয়া করে সৃষ্টি হয়। এটি চিকিৎসা ক্ষেত্রে ক্যালসিয়াম সাপ্লিমেন্ট বা অ্যান্টাসিড হিসেবে ব্যবহৃত হয়। তবে অত্যধিক ব্যবহার বিপজ্জনক।
রসায়ন
[সম্পাদনা]ক্যালসিয়াম কার্বনেট অন্যান্য কার্বনেটের মত তার আদর্শ ধর্মাবলী ভাগাভাগি করে;তাদের মধ্যে উল্লেখযোগ্য কিছু হলোঃ
এটা শক্তিশালি এসিড এর সাথে বিক্রিয়া করে কার্বন-ডাই-অক্সাইড ত্যাগ করেঃ
CaCO3(s) + 2 HCl(aq) → CaCl2(aq) + CO2(g) + H2O(l)
এটা উষ্ণ বিয়োজন বিক্রিয়া বা ক্যালসিনেশন (যখন CaCo3 840°C এর উপরে)এ উত্তপ্ত হয়ে এন্থাল্পির(178 kJ/mole) সাথে বিক্রিয়ায় কার্বন ডাই অক্সাইড ত্যাগ করে ও ক্যালসিয়াম অক্সাইড উৎপন্ন করে,যা কলিচুন নামে পরিচিতঃ
CaCO3(s) → CaO(s) + CO2(g)
ক্যালসিয়াম কার্বনেট পানিতে সম্পৃক্ত কার্বন ডাই অক্সাইড এর সাথে বিক্রিয়ায় দ্রবণীয় ক্যালসিয়াম বাইকার্বনেট গঠন করেঃ
CaCO3 + CO2 + H2O → Ca(HCO3)2
কার্বনেট শিলার ক্ষয়প্রাপ্তিতে,ভূগর্ভে সুড়ঙ্গ সৃষ্টিতে ও পৃথিবীর বিভিন্ন স্থানে খর পানি তৈরিতে এই বিক্রিয়া গুরুত্ব বহন করে। এর উপাদান গুলোর মধ্যে হেক্সাহাইড্রেট,ইকাইট, CaCO3·6H2O যা শুধু 6 °C এর নিচে অবস্থান করে।
প্রস্তুতপ্রণালী
[সম্পাদনা]ইন্ডাস্ট্রিতে যে বিপুল পরিমাণ ক্যালসিয়াম কার্বনেট ব্যবহার করা হয় তা মূলত খনি বা অন্য উৎস হতে সংগ্রহ করা হয়।বিশুদ্ধ ক্যালসিয়াম কার্বনেট (বিশেষত;খাবার বা ওষূধ তৈরিতে)কোন ভেজাল মুক্ত উৎস হতে সংগ্রহ করা যায়। তবে বিকল্প হিসেবে,ক্যালসিয়াম অক্সাইড হতে ক্যালসিয়াম কার্বনেট উৎপন্ন করা হয়।তাই,প্রথমে ক্যালসিয়াম হাইড্রক্সাইড এর সাথে পানি যোগ করা হয়,তারপর এই দ্রবনের ভিতর দিয়ে কার্বন ডাই অক্সাইড পরিচালনা করা হয় হয় যাতে কাঙ্ক্ষিত ক্যালসিয়াম কার্বনেট ঘণীভূত অবস্থায় পাওয়া যায়;যেটাকে ইন্ড্রস্ট্রিতে precipitated calcium carbonate হিসেবে অভিহিত করা হয় (PCC):[৭]
- CaO + H2O → Ca(OH)2
- Ca(OH)2 + CO2 → CaCO3 + H2O
গঠণপ্রণালী
[সম্পাদনা]সাধারণ অবস্থায় CaCO3 এর গঠন ষড়ভুজ আকৃতির β-CaCO3, (খনিজ ক্যালসাইট) [৮]
তথ্যসূত্র
[সম্পাদনা]- ↑ "Occupational safety and health guideline for calcium carbonate" (পিডিএফ)। US Dept. of Health and Human Services। সংগ্রহের তারিখ ৩১ মার্চ ২০১১।
- ↑ Aylward, Gordon and Findlay, Tristan (২০০৮)। SI Chemical Data Book (4th ed.)। John Wiley & Sons Australia, Ltd.। আইএসবিএন 978-0-470-81638-7।
- ↑ Rohleder, J.; Kroker, E. (২০০১)। Calcium Carbonate: From the Cretaceous Period Into the 21st Century। Springer Science & Business Media। আইএসবিএন 3-7643-6425-4।
- ↑ Patnaik, Pradyot (২০০৩)। Handbook of Inorganic Chemical Compounds। McGraw-Hill। আইএসবিএন 0-07-049439-8।
- ↑ ক খ Zumdahl, Steven S. (২০০৯)। Chemical Principles 6th Ed.। Houghton Mifflin Company। পৃষ্ঠা A21। আইএসবিএন 0-618-94690-X।
- ↑ "NIOSH Pocket Guide to Chemical Hazards #0090" (ইংরেজি ভাষায়)। ন্যাশনাল ইনস্টিটিউট ফর অকুপেশনাল সেফটি অ্যান্ড হেলথ (NIOSH)।
- ↑ "Precipitated Calcium Carbonate"। ১১ জানুয়ারি ২০১৪ তারিখে মূল থেকে আর্কাইভ করা। সংগ্রহের তারিখ ১১ জানুয়ারি ২০১৪।
- ↑ R C Ropp Elsevier। Encyclopedia of the alkaline earth compounds। Elsevier। পৃষ্ঠা 359–370। আইএসবিএন 9780444595508।