Piridin
| Piridin | |
|---|---|
    | |
| Općenito | |
| Hemijski spoj | Piridin |
| Druga imena | Azabenzen Azin Azinin 1-Azacikloheksa-1,3,5-trien |
| Molekularna formula | C5H5N |
| CAS registarski broj | 110-86-1 |
| InChI | 1/C5H5N/c1-2-4-6-5-3-1/h1-5H |
| Kratki opis | Bezbojna tečnost, neprijtnog mirisa na ribu |
| Osobine1 | |
| Gustoća | 0,9819 g/mL |
| Tačka topljenja | −41,6 |
| Tačka ključanja | 115,2 |
| Pritisak pare | 16 mmHg (20 °C)< |
| Rastvorljivost | Miješa se |
| Dipolni moment | 2,2 D PubChem: 1049 |
| Rizičnost | |
| NFPA 704 | |
| 1 Gdje god je moguće korištene su SI jedinice. Ako nije drugačije naznačeno, dati podaci vrijede pri standardnim uslovima. | |

Piridin je osnovni heterociklični organski spoj sa hemijskom formulom C5H5 N. Strukturno je povezan sa benzenom, jednom metinskom grupom (=CH−) zamijenjenim atomom dušika. To je lahko zapaljiva, slabo bazna tekućina koja se miješa s vodom, prepoznatljivog, neugodnog mirisa poput ribe. Piridin je bezbojan, a li stariji ili nečisti uzorci mogu izgledati žuto. Piridinski prsten se javlja u mnogim važnim spojevima, uključujući agrohemijske, farmaceutske i vitaminske sastojke. U prošlosti se piridin proizvodio od ugljenskog katrana. Danas se u svijetu sintetizira na skali od oko 20.000 tona godišnje.
Svojstva
[uredi | uredi izvor]
Fizička svojstva
[uredi | uredi izvor]
Molekulski električni dipolni moment je 2,2 debeja.[1] Piridin je diamagnetni i ima dijamagnetnu osjetljivost od −48.7 × 10−6 cm3•mol−1.[2]Standardna entalpija formiranja tečne faze je 100,2 kJ•mol−1 i 140,4 kJ•mol−1 u plinovitoj fazi. Na 25 °C piridin je viskozan na 0,88 mPa/s i toplotno provodljiv od 0,166 W•m−1•K−1.[3] entalpija isparavanja je 35,09 kJ•mol−1 na tački ključanja i normalnom pritisku.[4] Entalpija fuzije je 8,28 kJ • mol−1 na tački topljenja.[5]
Kritični parametri piridina su pritisak 6,70 MPa, temperatura 620 K i zapremina 229 cm3•mol−1. U temperaturnom opsegu 340–426 °C, njegov pritisak pare p može se opisati pomoću Antoineove jednadžbe: gdje T = temperatura, A = 4,16272, B = 1371.358 K i C = −58.496 K.[6]
Struktura
[uredi | uredi izvor]Piridinski prsten tvori C5N šesterokut. Primjećuju se male varijacije udaljenosti C-C i C-N, kao i uglovi veze.
Kristalografija
[uredi | uredi izvor]Piridin kristalizira po ortorombnom sistemu kristala sa prostornom‘grupom Pna21 i parametrima rešetke a = 1752 pm, b = 897 pm, c = 1135 pm, i po 16 jediničnih ćelija (izmjereno na 153 K). Za usporedbu, kristalni benzen je također ortorombski, sa prostornom grupom Pbca, a = 729,2 pm, b = 947,1 pm, c = 674,2 pm (na 78 K), ali broj molekula u ćeliji je samo 4.[7] Ova razlika dijelom je povezana s nižom simetrijom pojedinačne molekule piridina (C2v nasuprot D6h za benzen). Poznat je tri hidrata (piridin•3H2O); također kristalizira u ortorombičnom sistem u prostornoj grupi Pbca, sa parametrima rešetke.[8]
Spektroskopija
[uredi | uredi izvor]Optički spektar apsorpcije piridina u heksanu sadrži tri trake na talasnim dužinama 195 nm (π → π* tranzicija, molarna apsortivnost ε = 7500 L·mol−1·cm−1), 251 nm (π → π* tranzicija, ε = 2000 L·mol−1·cm−1) and 270 nm (n → π* tranzicija, ε = 450 L·mol−1·cm−1).
1H nuklearna magnetna rezonancija (NMR) spektar piridina sadrži tri signala s integriranim omjerom intenziteta 2: 1: 2, koji odgovaraju tri hemijski različita protona u molekuli. Ti signali potiču iz α-protona (položaji 2 i 6, hemijskog pomaka 8,5 ppm), γ-protona (položaj 4, 7,5 ppm) i β-protona (položaji 3 i 5, 7,1 ppm). Ugljični analog piridina, benzen, ima samo jedan protonski signal pri 7,27 ppm. Veći hemijski pomaci α- i γ-protona u odnosu na benzen rezultat su niže elektronske gustine u α- i γ-položajima, koja se može izvesti iz rezonantnih struktura. Situacija je prilično slična za 13C NMR spektre piridina i benzena: piridin pokazuje triplet na δ(α-C) = 150 ppm, δ(β-C) = 124 ppm i δ(γ-C) = 136 ppm, dok benzen ima jednu liniju pri 129 ppm. Svi pomaci navedeni su za supstance bez rastvarača. Piridin se konvencionalno detektira pomoću metoda gasne hromatografije i masene spektrometrije.
Hemijska svojstva
[uredi | uredi izvor]Zbog elektronegativnog dušika u piridinskom prstenu, molekula ima relativni nedostatak elektrona. Stoga manje lahko ulazi u reakcije elektrofilne aromatske supstitucije od derivata benzena. Odgovarajuće tome, piridin je skloniji nukleofilnoj supstituciji, što dokazuje lahkoća metaliranja jakim organometalnim bazama. Reaktivnost piridina može se razlikovati za tri hemijske grupe. Sa elektrofilima, odvija se elektrofilna supstitucija tamo gdje piridin ispoljava aromatska svojstva. Sa nukleofilim, piridin reagira na položajima 2 i 4 i tako se ponaša slično iminima i karbonilima. Reakcija s mnogim Lewisovom kiselinom rezultira dodavanjem atoma dušika piridinu, što je slično reaktivnosti tercijarnih amina. Sposobnost piridina i njegovih derivata da oksidiraju, formirajući amin okside (N-oksidi), također je karakteristika tercijarnih amina.[9]
Dušični centar piridina sadrži osnovni usamljeni par elektrona. Ovaj usamljeni par se ne preklapa sa aromatskim prstenom π-sistema pa, prema tome, piridin je baza (hemija) baza, koja ima hemijska svojstva slična onima tercijarnih amina. Protonacija daje piridinij, C5H5NH+. Konstanta pKa konjugovane kiseline (piridinijev kation) je 5,25. Strukture piridina i piridinija su gotovo identične.[10] Kation piridinija je izoelektronski sa benzenom. Piridinij p -toluensulfonat (PPTS) je ilustrativna piridinijeva so; proizvodi se tretiranjem piridina p-toluensulfonskom kiselinom. Pored protonacije, piridin prolazi kroz alkilaciju, aciliranje i N- oksidaciju u N-centru).
Vezanje
[uredi | uredi izvor]
Piridin ima konjugirani sistem od šest π elektrona koji su delokalizirani preko prstena. Molekula je ravna i, prema tome, slijedi Hückelov kriterij za aromatske sisteme. Za razliku od benzena, gustina elektrona nije ravnomjerno raspoređena po prstenu, što odražava negativni induktivni efekt atoma dušika. Zato piridin ima dipolni moment i slabiju rezonantna stabilizaciju od benzena (117 kJ · mol−1 u piridinu nasuprot 150 kJ · mol −1 u benzenu).
Atomi prstena u molekuli piridina su sp2-hibridizirani. ADušik je uključen u π-vezujući aromatski sistem. koristeći svoj nehibridiziranu p-orbitalu. Usamljeni par nalazi se u sp2 orbitali, stršeći prema vani iz prstena u istoj ravni kao i σ veza. Kao rezultat, usamljeni par ne doprinosi aromatskom sistemu, ali bitno utiče na hemijska svojstva piridina, jer lahko podržava stvaranje veza elektrofilnim napadom. Međutim, zbog odvajanja usamljenog para od aromatskog prstenastog sistema, atom dušika ne može pokazati pozitivan mezomerni efekt.
Poznati su mnogi analozi piridina gdje je N zamijenjen drugim heteroatomima (vidi sliku dolje). Zamjenom jednog C – H u piridinu, drugim N nastaju heterocikli diazina (C4H4N2), zvani piridazin, pirimidin i pirazin.
 |
 |
 |
 |
Izvori
[uredi | uredi izvor]U prirodi piridina nema u izobilju, osim lišća i korijenja Atropa belladonna[11] i Althaea officinalis.[12] Derivati piridina, međutim, često su dio biomolekula kao što su alkaloidi.
U svakodnevnom životu, količine piridina u tragovima sastojci su isparljivih organskih spojeva koji se proizvode u postupcima prženja i konzerviranja, npr. u prženoj piletini,[13] sukijaki,[14] prženoj kahvi,[15] krompirskom čipsu,[16] i pečenoj šunki.[17] Tragovi piridina mogu se naći u beaufortskom siru,[18] vaginskim sekretima,[19] crnom čaju,[20] pljuvački osoba koje pate od gingivitisa,[21] i suncokretovom medu.[22]
-
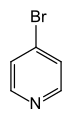
4-bromopiridin
-
2,2'-bipiridin
-
piridin-2,6-dikarboksilna kiselina (dipikolinska kiselina)
-
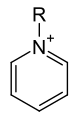
Opći oblik piridinijevog kationa
Proizvodnja
[uredi | uredi izvor]U prošlosti se piridin ekstrahirao iz katranskog uglja ili se dobijao kao nusprodukt gasifikacije uglja, Proces je trajao naporno i neefikasno: katranski ugalj sadrži samo oko 0,1% piridina,[23] i zato je bilo potrebno višestepeno pročišćavanje, što je dodatno smanjilo izlaz. Danas se većina piridina proizvodi sintetski pomoću reakcija različitih naziva.[24]
U 1989., u svijetu je proizvedeno 26.000 tona piridina. Među najvećih 25 lokacija za proizvodnju piridina, jedanaest se nalazi u Evropi (od 1999.). Glavni proizvođači uključuju kompanija Evonik Industries, Rütgers Chemicals, Jubilant Life Sciences, Imperial Chemical Industries i Koei ChemicalIn. Proizvodnja piridina značajno se povećala početkom 2000-ih, s godišnjim proizvodnim kapacitetom od 30.000 tona samo u kontinentalnoj Kini.[25] Američko-kinesko zajedničko ulaganje u Vertellus sada je svjetski lider u proizvodnji piridina.[26]
Biosinteza
[uredi | uredi izvor]Nekoliko derivata piridina ima važnu ulogu u biološkim sistemima. Iako njegova biosinteza nije u potpunosti razumljiva, nikotinska kiselina (vitamin B3) javlja se kod nekih bakterija, gljiva i sisara. Sisari sintetiziraju nikotinsku kiselinu oksidacijom aminokiseline triptofana, pri čemu međuprodukt, anilin, stvara derivat piridina, kinurenin. Suprotno tome, bakterije Mycobacterium tuberculosis i Escherichia coli proizvode nikotinsku kiselinu kondenzacijom gliceraldehid 3-fosfata i asparaginske kiseline.[27]
Primjena
[uredi | uredi izvor]Piridin ima široku primjenu u raznim oblastima proizvodnje:
- Pesticidi;
- Rastvarači;
- Specijalni reagensi

Rizici
[uredi | uredi izvor]Piridin se dodaje u etanol da bi bio neprikladan za piće. U malim dozama piridin se dodaje hrani kako bi im dao gorak okus, a takvu upotrebu u SAD odobrile su Uprava za lijekove i agencija je i dalje smatra sigurnom, iako ju je vanjsko lobiranje prisililo da zabrani upotrebu piridina kao sintetskog okusa u 2018.[28] Prag detekcije piridina u rastvorima je oko 1–3 mmola /L−1 (79–237 mg·L−1).[29]
Piridin ima tačku paljenja na 17 °C i stoga je vrlo zapaljiv. Temperatura paljenja mu je 550 °C, a mješavine 1,7–10,6 vol.% piridina sa zrakom eksplozivne su. Termička modifikacija piridina započinje iznad 490 °C, što rezultira bipiridinom (uglavnom 2,2'-bipiridinom i u manjoj meri 2,3'-bipiridinom i 2,4'-bipiridinom), dušik-oksidima i ugljik-monoksidom.[30] Maksimalno dozvoljena koncentracija piridina bila je 15–30 dijelova na milion (ppm ili 15–30 mg · m 3 u zraku) u većini zemalja u 1990-im, ali je 2000-ih smanjena na 5 ppm.[31] Za usporedbu, unutrašnji zrak kontaminiran duhanskim dimom može sadržavati do 16 µg · m−3 piridina, a jedna cigareta sadrži 21–32 µg.
Također pogledajte
[uredi | uredi izvor]Reference
[uredi | uredi izvor]- ^ RÖMPP Online – Version 3.5. Thieme Chemistry. Stuttgart: Georg Thieme. 2009.
- ^ Lide, p. 3-673
- ^ Lide, p. 6-221
- ^ Majer, V.; Svoboda, V. (1985). Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation. Oxford: Blackwell Scientific Publications. ISBN 0-632-01529-2.
- ^ Domalski, Eugene S.; Hearing, Elizabeth D. (1996). "Heat Capacities and Entropies of Organic Compounds in the Condensed Phase". Journal of Physical and Chemical Reference Data. 25 (1): 1. Bibcode:1996JPCRD..25....1D. doi:10.1063/1.555985.
- ^ McCullough, J. P.; Douslin, D. R.; Messerly, J. F.; Hossenlopp, I. A.; Kincheloe, T. C.; Waddington, Guy (1957). "Pyridine: Experimental and Calculated Chemical Thermodynamic Properties between 0 and 1500 °K.; a Revised Vibrational Assignment". Journal of the American Chemical Society. 79 (16): 4289. doi:10.1021/ja01573a014.
- ^ Cox, E. (1958). "Crystal Structure of Benzene". Reviews of Modern Physics. 30 (1): 159–162. Bibcode:1958RvMP...30..159C. doi:10.1103/RevModPhys.30.159.
- ^ Mootz, D. (1981). "Crystal structures of pyridine and pyridine trihydrate". The Journal of Chemical Physics. 75 (3): 1517–1522. Bibcode:1981JChPh..75.1517M. doi:10.1063/1.442204.
- ^ Milcent, R.; Chau, F. (2002). Chimie organique hétérocyclique: Structures fondamentales. EDP Sciences. str. 241–282. ISBN 2-86883-583-X.
- ^ Krygowski, T. M.; Szatyowicz, H.; Zachara, J. E. (2005). "How H-bonding Modifies Molecular Structure and π-Electron Delocalization in the Ring of Pyridine/Pyridinium Derivatives Involved in H-Bond Complexation". J. Org. Chem. 70 (22): 8859–8865. doi:10.1021/jo051354h. PMID 16238319.
- ^ Burdock, G. A., ured. (1995). Fenaroli's Handbook of Flavor Ingredients. 2 (3rd izd.). Boca Raton: CRC Press. ISBN 0-8493-2710-5.
- ^ Täufel, A.; Ternes, W.; Tunger, L.; Zobel, M. (2005). Lebensmittel-Lexikon (4th izd.). Behr. str. 450. ISBN 3-89947-165-2.
- ^ Tang, Jian; Jin, Qi Zhang; Shen, Guo Hui; Ho, Chi Tang; Chang, Stephen S. (1983). "Isolation and identification of volatile compounds from fried chicken". Journal of Agricultural and Food Chemistry. 31 (6): 1287. doi:10.1021/jf00120a035.
- ^ Shibamoto, Takayuki; Kamiya, Yoko; Mihara, Satoru (1981). "Isolation and identification of volatile compounds in cooked meat: sukiyaki". Journal of Agricultural and Food Chemistry. 29: 57–63. doi:10.1021/jf00103a015.
- ^ Aeschbacher, HU; Wolleb, U; Löliger, J; Spadone, JC; Liardon, R (1989). "Contribution of coffee aroma constituents to the mutagenicity of coffee". Food and Chemical Toxicology. 27 (4): 227–232. doi:10.1016/0278-6915(89)90160-9. PMID 2659457.
- ^ Buttery, Ron G.; Seifert, Richard M.; Guadagni, Dante G.; Ling, Louisa C. (1971). "Characterization of Volatile Pyrazine and Pyridine Components of Potato Chips". Journal of Agricultural and Food Chemistry. Washington, DC: ACS. 19 (5): 969–971. doi:10.1021/jf60177a020.
- ^ Ho, Chi Tang; Lee, Ken N.; Jin, Qi Zhang (1983). "Isolation and identification of volatile flavor compounds in fried bacon". Journal of Agricultural and Food Chemistry. 31 (2): 336. doi:10.1021/jf00116a038.
- ^ Dumont, Jean Pierre; Adda, Jacques (1978). "Occurrence of sesquiterpene in mountain cheese volatiles". Journal of Agricultural and Food Chemistry. 26 (2): 364. doi:10.1021/jf60216a037.
- ^ Labows, John N., Jr.; Warren, Craig B. (1981). "Odorants as Chemical Messengers". u Moskowitz, Howard R. (ured.). Odor Quality and Chemical Structure. Washington, DC: American Chemical Society. str. 195–210. doi:10.1021/bk-1981-0148.fw001. ISBN 9780841206076.
- ^ Vitzthum, Otto G.; Werkhoff, Peter; Hubert, Peter (1975). "New volatile constituents of black tea flavor". Journal of Agricultural and Food Chemistry. 23 (5): 999. doi:10.1021/jf60201a032.
- ^ Kostelc, J. G.; Preti, G.; Nelson, P. R.; Brauner, L.; Baehni, P. (1984). "Oral Odors in Early Experimental Gingivitis". Journal of Periodontology Research. 19 (3): 303–312. doi:10.1111/j.1600-0765.1984.tb00821.x. PMID 6235346.
- ^ Täufel, A.; Ternes, W.; Tunger, L.; Zobel, M. (2005). Lebensmittel-Lexikon (4th izd.). Behr. str. 226. ISBN 3-89947-165-2.
- ^ Gossauer, A. (2006). Struktur und Reaktivität der Biomoleküle. Weinheim: Wiley-VCH. str. 488. ISBN 3-906390-29-2.
- ^ Shimizu, S.; Watanabe, N.; Kataoka, T.; Shoji, T.; Abe, N.; Morishita, S.; Ichimura, H. (2005), "Pyridine and Pyridine Derivatives", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a22_399 CS1 održavanje: nepreporučeni parametar (link)
- ^ "Pyridine's Development in China". AgroChemEx. 11. 5. 2010. Arhivirano s originala, 20. 9. 2018. Pristupljeno 7. 1. 2011.
- ^ "About Vertellus". vertellus.com. Arhivirano s originala, 18. 9. 2012. Pristupljeno 7. 1. 2011.
- ^ Tarr, J. B.; Arditti, J. (1982). "Niacin Biosynthesis in Seedlings of Zea mays". Plant Physiology. 69 (3): 553–556. doi:10.1104/pp.69.3.553. PMC 426252. PMID 16662247.
- ^ "FDA Removes 7 Synthetic Flavoring Substances from Food Additives List". 5. 10. 2018. Pristupljeno 8. 10. 2018.
- ^ Täufel, A.; Ternes, W.; Tunger, L.; Zobel, M. (2005). Lebensmittel-Lexikon (4th izd.). Behr. str. 218. ISBN 3-89947-165-2.
- ^ "Database of the (EPA)". U.S. Environmental Protection Agency.
- ^ "Pyridine MSDS" (PDF). Alfa Aesar. Arhivirano s originala (PDF), 3. 4. 2015. Pristupljeno 3. 6. 2010.
Dopunska literatura
[uredi | uredi izvor]- Joule, J. A.; Mills, K. (2010). Heterocyclic Chemistry (5th izd.). Chichester: Blackwell Publishing. ISBN 978-1-4051-3300-5.
- Lide, D. R., ured. (2009). Handbook of Chemistry and Physics (90th izd.). Boca Raton: CRC Press. ISBN 978-1-4200-9084-0.