Fluoridy kyslíku


Fluoridy kyslíku jsou sloučeniny kyslíku a fluoru s obecným vzorcem OnF2, kde n=1 až 6. Je známo mnoho různých fluoridů kyslíku:
- Monofluorid kyslíku (OF)
- Difluorid kyslíku (OF2)
- Fluorid dioxygenylu (O2F2)
- Fluorid trioxygenylu nebo fluorid ozonidu (O3F2)[1][2]
- Fluorid tetraoxygenylu (O4F2)[3]
- Fluorid pentaoxygenylu (O5F2)
- Fluorid hexaoxygenylu (O6F2)[4]
- Fluorperoxyl (O2F)
Fluoridy kyslíku jsou silná oxidační činidla s vysokou energií a mohou uvolňovat svoji energii buď najednou, nebo řízenou rychlostí. Fluoridy kyslíku mohou být potenciální paliva v proudových motorech.[5]
Příprava, vlastnosti a reakce
[editovat | editovat zdroj]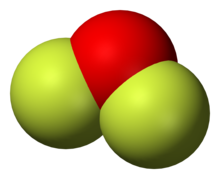
Difluorid kyslíku
[editovat | editovat zdroj]Difluorid kyslíku se běžně připravuje fluorací hydroxidu sodného:
- 2 F2 + 2 NaOH → OF2 + 2 NaF + H2O K.
Difluorid kyslíku je bezbarvý plyn při pokojové teplotě a pod 128 K je to žlutá kapalina. Difluorid kyslíku má dráždivý zápach a je jedovatý.[3] Reaguje s halogenvodíkovými kyselinami za vzniku volných halogenů:
- OF2 + 4 HCl → 2 Cl2 + 2 HF + 2 H2O
Difluorid kyslíku může také vytěsnit halogeny z jejich solí.[3] Je to také účinné fluorační a oxidační činidlo. Při reakci s nenasycenými fluoridy dusíku za elektrického výboje dochází ke vzniku fluoridu dusitého, fluoridů kyslíku a jiných oxidů.[6][7]

Fluorid dioxygenylu
[editovat | editovat zdroj]Fluorid dioxygenylu se vysráží jako hnědá pevná látka po ozařování směsi kapalného kyslíku a fluoru UV zářením při teplotě −196 °C.[8] Zdá se, že fluorid dioxygenylu je stabilní pouze pod −160 °C.[9] Obecně lze připravit mnoho fluoridů kyslíku elektrickým výbojem v plynné fázi ve studených nádobách.[10] Lze takto připravit také fluorid dioxygenylu:[10]
- O2 + F2 → O2F2 (elektrický výboj, 183 °C)
Je to oranžovožlutá pevná látka, která se rozkládá na kyslík a fluor v blízkosti svého bodu varu při 216 K.[3]
Fluorid dioxygenylu prudce reaguje s červeným fosforem, dokonce i při −196 °C. Výbuchy mohou nastat i když Freon-13 je použit ke zmírnění reakce.[9]

Fluorid trioxygenylu
[editovat | editovat zdroj]Fluorid trioxygenylu je viskózní krvavě červená kapalina. Při 90 K zůstává fluorid trioxygenylu kapalný, čímž jej lze odlišit od fluoridu dioxygenylu, který má bod tání při asi 109 K.[3][11]
Stejně jako ostatní fluoridy kyslíku je fluorid trioxygenylu endotermický a rozkládá se při přibližně 115 K za vývoji tepla, podle následující reakce:
2 O3F2 → O2 + 2 O2F2
S fluoridem trioxygenylu je bezpečnější pracovat než s ozonem a lze jej odpařit, tepelně rozložit nebo vystavit působení jisker, aniž by došlo k explozi. Při kontaktu s organickou hmotou nebo s oxidovatelnými sloučeninami může explodovat. Přidáním i jediné kapky fluoridu trioxygenylu k pevnému bezvodému čpavku povede k mírné explozi, když mají obě látky teplotu 90 K.[3]
Fluorperoxyl
[editovat | editovat zdroj]Fluorperoxyl je molekula, která je stabilní pouze při nízké teplotě. Lze jej připravit z fluoru a kyslíku:[12]
O2 + F → O2F
Příprava fluoridů oxygenylu
[editovat | editovat zdroj]| Rovnice reakce[6] | Poměr O2:F2 podle objemu | Proud (mA) | Teplota lázně (°C) |
|---|---|---|---|
| O2 + F2 ⇌ O2F2 | 1:1 | 10 - 50 | ~ -196° |
| 3 O2 + 2 F2 ⇌ 2 O3F2 | 3:2 | 25 - 30 | ~ -196° |
| 2 O2 + F2 ⇌ O4F2 | 2:1 | 4 - 5 | ~ -205° |
Vliv na ozon
[editovat | editovat zdroj]V atmosféře se vyskytují radikály fluoru a kyslíku, jako O2F a OF. Tyto radikály se podílejí na ničení ozonu v atmosféře. Předpokládá se, že monofluoridové radikály nehrají tak významnou roli při poškozování ozonu, protože volné atomy fluoru v atmosféře reagují s methanem za vzniku kyseliny fluorovodíkové, která se sráží v dešti. Tím se snižuje dostupnost volných iontů fluoru pro atomy kyslíku se kterými reagují a ničí molekuly ozonu:[13]
- O3 + F → O2 + OF
- O + OF → O2 + F
Sumární reakce:
- O3 + O → 2 O2
Hypergolické palivo
[editovat | editovat zdroj]Navzdory nízké rozpustnosti fluoridu trioxygenylu v kapalném kyslíku se ukázalo, že je hypergolické s většinou raketových paliv. Mechanismus zahrnuje vyvaření kyslíku z roztoku obsahujícího fluorid trioxygenylu, díky čemuž spontánně reaguje s raketovým palivem. Reaktivita je závislá na druhu použitého paliva.[3]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Oxygen fluoride na anglické Wikipedii.
- ↑ SOLOMON, I. J.; KEITH, J. N.; KACMAREK, A. J. Additional studies concerning the existence of "O3F2". Journal of the American Chemical Society. 1968-09, roč. 90, čís. 20, s. 5408–5411. Dostupné online [cit. 2023-11-19]. ISSN 0002-7863. DOI 10.1021/ja01022a014. (anglicky)
- ↑ MISOCHKO, Eugenii Ya.; AKIMOV, Alexander V.; WIGHT, Charles A. Infrared Spectroscopic Observation of the Stabilized Intermediate Complex FO 3 Formed by Reaction of Mobile Fluorine Atoms with Ozone Molecules Trapped in an Argon Matrix. The Journal of Physical Chemistry A. 1999-10-01, roč. 103, čís. 40, s. 7972–7977. Dostupné online [cit. 2023-11-19]. ISSN 1089-5639. DOI 10.1021/jp9921194. (anglicky)
- ↑ a b c d e f g STRENG, A. G. The Oxygen Fluorides. Chemical Reviews. 1963-12-01, roč. 63, čís. 6, s. 607–624. Dostupné online [cit. 2023-11-19]. ISSN 0009-2665. DOI 10.1021/cr60226a003. (anglicky)
- ↑ STRENG, A. G.; GROSSE, A. V. Two New Fluorides of Oxygen, O 5 F 2 and O 6 F 2 1,2. Journal of the American Chemical Society. 1966-01, roč. 88, čís. 1, s. 169–170. Dostupné online [cit. 2023-11-19]. ISSN 0002-7863. DOI 10.1021/ja00953a035. (anglicky)
- ↑ JÄGER, Susanne; VON JOUANNE, Jörn; KELLER-RUDEK, Hannelore. Fluorine and Oxygen. Příprava vydání Susanne Jäger, Jörn von Jouanne, Hannelore Keller-Rudek, Dieter Koschel, Peter Kuhn, Peter Merlet, Sigrid Rupecht, Hans Vanecek, Joachim Wagner, Dieter Koschel, Peter Kuhn, Peter Merlet, Sigrid Ruprecht, Joachim Wagner. Berlin, Heidelberg: Springer (Gmelin Handbook of Inorganic Chemistry / Gmelin Handbuch der Anorganischen Chemie). Dostupné online. ISBN 978-3-662-06339-2. DOI 10.1007/978-3-662-06339-2_1. S. 1–161. (anglicky)
- ↑ a b NIKITIN, Igor V; ROSOLOVSKII, V Ya. Oxygen Fluorides and Dioxygenyl Compounds. Russian Chemical Reviews. 1971-11-30, roč. 40, čís. 11, s. 889–900. Dostupné online [cit. 2023-11-19]. ISSN 0036-021X. DOI 10.1070/RC1971v040n11ABEH001981.
- ↑ AUTERHOFF, Gert. Inorganic high‐energy oxidizers. Synthesis, structure, and properties. Von E. W. Lawless and I. C. Smith. Marcel Dekker, Inc., New York, Sept. 1968, 304 S. Preis: Leinw. S 14.75. Archiv der Pharmazie. 1969-01, roč. 302, čís. 3, s. 237–238. Dostupné online [cit. 2023-11-19]. ISSN 0365-6233. DOI 10.1002/ardp.19693020317. (anglicky)
- ↑ MARX, Rupert; SEPPELT, Konrad. Structure investigations on oxygen fluorides. Dalton Transactions. 2015, roč. 44, čís. 45, s. 19659–19662. Dostupné online [cit. 2023-11-19]. ISSN 1477-9226. DOI 10.1039/C5DT02247A. (anglicky)
- ↑ a b RESEARCH ON CHEMISTRY OF O3F2 AND O2F2. [s.l.]: Defense Technical Information Center 20 s. Dostupné online. (anglicky)
- ↑ a b GOETSCHEL, Charles T.; CAMPANILE, Vincent A.; WAGNER, Charles Daniel. Low-temperature radiation chemistry. I. Preparation of oxygen fluorides and dioxygenyl tetrafluoroborate. Journal of the American Chemical Society. 1969-08, roč. 91, čís. 17, s. 4702–4707. Dostupné online [cit. 2023-11-19]. ISSN 0002-7863. DOI 10.1021/ja01045a020. (anglicky)
- ↑ DE MARCO, Ronald A.; SHREEVE, Jean'ne M. Fluorinated Peroxides. Příprava vydání H. J. Emeléus, A. G. Sharpe. Svazek 16. [s.l.]: Academic Press Dostupné online. DOI 10.1016/s0065-2792(08)60291-5. S. 109–176. DOI: 10.1016/S0065-2792(08)60291-5.
- ↑ LYMAN, John L.; HOLLAND, Redus. Oxygen fluoride chemical kinetics. The Journal of Physical Chemistry. 1988-12, roč. 92, čís. 26, s. 7232–7241. Dostupné online [cit. 2023-11-19]. ISSN 0022-3654. DOI 10.1021/j100337a015. (anglicky)
- ↑ FRANCISCO, J. S. An ab initio investigation of the significance of the HOOF intermediate in coupling reactions involving FOO x and HO x species. The Journal of Chemical Physics. 1993-02-01, roč. 98, čís. 3, s. 2198–2207. Dostupné online [cit. 2023-11-19]. ISSN 0021-9606. DOI 10.1063/1.464199. (anglicky)
Související články
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Fluoridy kyslíku na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fluoridy kyslíku na Wikimedia Commons
