Oxid antimonitý
| Oxid antimonitý | |
|---|---|
 | |
| Obecné | |
| Systematický název | Oxid antimonitý |
| Anglický název | Antimony trioxide |
| Německý název | Antimon(III)-oxid |
| Sumární vzorec | Sb4O6 |
| Vzhled | Bílá práškovitá látka |
| Identifikace | |
| Registrační číslo CAS | 1309-64-4 |
| EC-no (EINECS/ELINCS/NLP) | 215-175-0 |
| Indexové číslo | 051-005-00-X |
| Vlastnosti | |
| Molární hmotnost | 291,52 g/mol |
| Teplota tání | 656 °C |
| Teplota varu | 1 426 °C |
| Teplota změny krystalové modifikace | 572 °C |
| Hustota | 5,19 g/cm3 (α-modifikace) 5,778 g/cm3 (β-modifikace) |
| Rozpustnost ve vodě | 1,4 mg/100 ml (30 °C) |
| Rozpustnost v polárních rozpouštědlech | rozpustný v koncentrovaných kyselinách a zásadách |
| Relativní permitivita εr | 12,8 |
| Tlak páry | 13,3 hPa (660 °C) |
| Měrná magnetická susceptibilita | −2,978 Sm−1 |
| Struktura | |
| Krystalová struktura | krychlová (α-modifikace) kosočtverečná (β-modifikace) |
| Hrana krystalové mřížky | a=1 113 pm (α-modifikace) a=492 pm; b=1 246 pm; c=542 pm (β-modifikace) |
| Koordinační geometrie | pyramida |
| Dipólový moment | 0 C.m |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −709 kJ/mol (α-modifikace) |
| Entalpie tání ΔHt | 188 J/g |
| Entalpie varu ΔHv | 256 J/g |
| Standardní molární entropie S° | 133 J.K−1.mol−1 (α-modifikace) |
| Standardní slučovací Gibbsova energie ΔGf° | −626,5 kJ/mol (α-modifikace) −617,8 (β-modifikace) |
| Bezpečnost | |
| [1] Varování[1] | |
| R-věty | R40 |
| S-věty | S2, S22, S36/37 |
| NFPA 704 |  1
2
0
|
Některá data mohou pocházet z datové položky. | |
Oxid antimonitý (chemický vzorec Sb4O6, někdy zkráceně jen Sb2O3) je nejdůležitější sloučeninou antimonu.
Příprava
[editovat | editovat zdroj]Oxid antimonitý lze připravit více způsoby:
- Spalováním elementárního antimonu na vzduchu:
4 Sb + 3 O2 → Sb4O6.
4 SbCl3 + 6 H2O → Sb4O6 + 12 HCl.
- Pražením minerálů antimonu (hlavní průmyslová metoda přípravy).
Chemické vlastnosti
[editovat | editovat zdroj]Oxid antimonitý je amfoterní oxid. Lze ho přímo oxidovat na oxid antimoničný nebo jiné sloučeniny antimoničné. Také ho lze jednoduše redukovat na antimon.
Struktura
[editovat | editovat zdroj]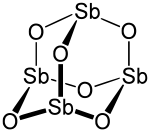
V pevném stavu se oxid antimonitý vyskytuje ve struktuře, která tvarem odpovídá struktuře adamantanu. Každý atom antimonu je vázán se třemi atomy kyslíku a ty následně s dalšími třemi atomy antimonu. Všechny atomy antimonu jsou tedy vzájemně provázány přes "kyslíkové můstky". Je proto vhodnější zapisovat vzorec oxidu jako Sb4O6 a nikoliv Sb2O3 i když tento zápis není chybně, ale nezachycuje plně strukturu sloučeniny.
V plynné fázi existuje tento oxid v dimerní formě Sb4O6, která je isostrukturní s oxidem fosforečným, tato forma je přítomna také v krystalické kubické formě. Monoklinická forma má lístkovou strukturu složenou z pyramidálních skupin {SbO3}, které sdílejí atom kyslíku.
Použití
[editovat | editovat zdroj]Toxikologie
[editovat | editovat zdroj]Oxid antimonitý je pouze slabě absorbován zažívací soustavou, hlavní cestou expozice je vdechování prachu. Vylučování antimonu z těla je pomalé, takže je nebezpečný z hlediska chronické toxicity. Akutní otravy nejsou časté.[zdroj?]
Reference
[editovat | editovat zdroj]- ↑ a b Senarmontite. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Literatura
[editovat | editovat zdroj]- VOHLÍDAL, JIŘÍ; ŠTULÍK, KAREL; JULÁK, ALOIS. Chemické a analytické tabulky. 1. vyd. Praha: Grada Publishing, 1999. ISBN 80-7169-855-5.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Oxid antimonitý na Wikimedia Commons
Obrázky, zvuky či videa k tématu Oxid antimonitý na Wikimedia Commons


