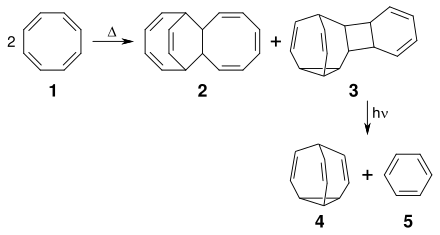
Bullvalen
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Bullvalen | ||||||||||||
| Andere Namen |
Tricyclo[3.3.2.02,8]deca-3,6,9-trien (IUPAC) | ||||||||||||
| Summenformel | C10H10 | ||||||||||||
| Kurzbeschreibung |
kristalliner Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 130,19 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
ab 400 °C: Zersetzung zu Naphthalin und Wasserstoff[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Bullvalen ist ein ungesättigter polycyclischer, verbrückter Kohlenwasserstoff mit einer Käfigstruktur, der trotz eines Cyclopropan-Strukturelements äußerst stabil ist.
Geschichte und Name
[Bearbeiten | Quelltext bearbeiten]Der Ursprung des Namens Bullvalen ist nicht sicher bekannt. Möglicherweise basiert er auf dem Spitznamen von William „Bull“ Doering, der 1963 gemeinsam mit Wolfgang Richard Roth aufgrund theoretischer Berechnungen die Eigenschaften des Moleküls vorhersagte.[4][5] Die Erstsynthese gelang im gleichen Jahr Gerhard Schröder durch Photolyse eines dimeren Cyclooctatetraen unter Abspaltung von Benzol.[6]
Darstellung
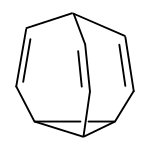
[Bearbeiten | Quelltext bearbeiten]Bullvalen ist synthetisch aus Cyclooctatetraen zugänglich. Durch Erhitzen von Cyclooctatetraen 1 erhält man ein Gemisch der beiden dimeren C16H16-Verbindungen 2 und 3.[7] Aus der pentacyclischen Verbindung 3, die ein Homotropiliden-Strukturelement aufweist, erhält man photochemisch durch UV-Bestrahlung Bullvalen 4 unter Abspaltung von Benzol 5.[6]
Eigenschaften und Reaktionen
[Bearbeiten | Quelltext bearbeiten]Bullvalen bildet farblose Kristalle mit einem Schmelzpunkt von 96 °C. Erst bei 400 °C zerfällt die Substanz in Naphthalin und Wasserstoff. Die Verbindung geht die zu erwartenden Additionsreaktionen ein, indem jeweils 4 Mol Brom oder Wasserstoff für drei Doppelbindungen und den Cyclopropanring verbraucht werden. Durch wiederholte Bromierung und anschließender Dehydrobromierung sind substituierte Bullvalenderivate leicht zugänglich.[8] Die Brombullvalene wiederum können durch bekannte Substitutionsreaktionen in Aryl-, Alkyl- oder Fluorbullvalene überführt werden.
Struktur
[Bearbeiten | Quelltext bearbeiten]Im Bullvalen sind die drei Kohlenstoffatome eines Cyclopropanrings über drei Vinylenbrücken sternförmig mit einem Methinrest zu einer überraschend stabilen tricyclischen Struktur verbunden.
Der Grund liegt in der Stabilisierung des Systems durch Valenzisomerie, in diesem Fall durch eine [3,3]-sigmatrope Umlagerung, der sogenannten Cope-Umlagerung. In einem diskreten Bullvalenmolekül liegen drei mögliche Cope-Systeme vor. Über einen sechsgliedrigen Übergangszustand bricht bei der Cope-Umlagerung im Bullvalen der Cyclopropanring auf und unter Verschiebung der Doppelbindungen wird ein neuer Cyclopropanring gebildet. Infolge der spezifischen Struktur des Bullvalens geht aus dieser Umlagerung jedoch wieder ein Bullvalenmolekül hervor, nur nehmen die Kohlenstoffatome individuell andere Plätze im neuen Molekül ein. Man bezeichnet dieses Phänomen auch als entartete Cope-Umlagerung
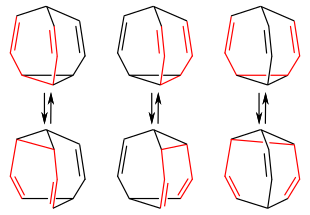
jeweiligen Valenzisomeren der intramolekularen Cope-Umlagerung
Ab 100 °C erfolgen die Cope-Umlagerungen zwischen den mehr als 1,2 Millionen Valenzisomeren (genau 10!/3 = 1.209.600 Möglichkeiten) so rasch, dass das 1H-NMR-Spektrum der Wasserstoffatome nur mehr ein einziges, scharfes Signal bei 4,2 ppm aufweist.[9] Das bedeutet, dass bei dieser Temperatur alle Wasserstoffatome gleichwertig sind und führte zum Ausdruck der „fluktuierenden Struktur“. Diese Annahme konnte durch Röntgenstrukturanalyse bei Raumtemperatur und Neutronenbeugungsexperimente bei 100 K bewiesen werden.[1]
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Ludwig Bergmann, Clemens Schaefer: Lehrbuch der Experimentalphysik: Bd. 6 Festkörper, S. 196, de Gruyter Verlag, 1999.
- ↑ Eintrag zu Bullvalen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 7. Juli 2014.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ W. V. E. Doering, W. R. Roth: Thermische Umlagerungsreaktionen. In: Angewandte Chemie. Band 75, Nr. 1, 7. Januar 1963, S. 27, doi:10.1002/ange.19630750106.
- ↑ Addison Ault: The Bullvalene Story. The Conception of Bullvalene, a Molecule That Has No Permanent Structure. In: Journal of Chemical Education. Band 78, Nr. 7, Juli 2001, S. 924, doi:10.1021/ed078p924.
- ↑ a b Gerhard Schröder: Synthese und Eigenschaften von Tricyclo[ 3.3.2.04.6]decatrien-(2.7.9)2.3)(Bullvalen). In: Chemische Berichte. Band 97, Nr. 11, November 1964, S. 3140, doi:10.1002/cber.19640971125.
- ↑ Gerhard Schröder: Die Eigenschaften zweier dimerer Cyclooctatetraene vom Schmp. 53 und 76°. In: Chemische Berichte. Band 97, Nr. 11, November 1964, S. 3131, doi:10.1002/cber.19640971124.
- ↑ Detlev Wendisch: Methoden zur Herstellung und Umwandlung carbocyclischer Dreiring-Systeme in: Houben-Weyl, Methods of Organic Chemistry Vol. IV/3, 4th Edition
- ↑ Martin Saunders: Measurement of the rate of rearrangement of bullvalene. In: Tetrahedron Letters. Band 4, Nr. 25, 1963, S. 1699–1702, doi:10.1016/S0040-4039(01)90897-4.