Klorometano
| Kloro-metano | |||||
 | |||||
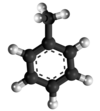
| Plata kemia strukturo de la Kloro-metano | |||||
 | |||||
| Tridimensia kemia strukturo de la Kloro-metano | |||||
| Alternativa(j) nomo(j) | |||||
| |||||
| Kemia formulo | |||||
| CAS-numero-kodo | 74-87-3 | ||||
| ChemSpider kodo | 6087 | ||||
| PubChem-kodo | 6327 | ||||
| Merck Index | 15,6112 | ||||
| Fizikaj proprecoj | |||||
| Aspekto | senkolora gaso kun milda dolĉeca odoro[1] | ||||
| Molmaso | 50,485 g·mol−1 | ||||
| Denseco | 1,74g cm−3 | ||||
| Fandpunkto | −97,4 °C | ||||
| Bolpunkto | −23,8 °C | ||||
| Ekflama temperaturo | −20 °C | ||||
| Memsparka temperaturo | 631 °C | ||||
| Acideco (pKa) | 45 | ||||
| Solvebleco | Akvo:reakcias | ||||
| Mortiga dozo (LD50) | 1800 mg/kg (buŝe) | ||||
| Sekurecaj Indikoj | |||||
| Riskoj | R10 R40 R48/20 | ||||
| Sekureco | S9 S16 S33 | ||||
| Pridanĝeraj indikoj | |||||
| Danĝero
| |||||
| GHS Damaĝo Piktogramo |
| ||||
| GHS Signalvorto | Averto | ||||
| GHS Deklaroj pri damaĝoj | H220, H280, H332, H351, H361, H373 | ||||
| GHS Deklaroj pri antaŭgardoj | P201, P202, P210, P260, P261, P271, P281, P304+312, P304+340, P308+313, P312, P314, P377, P381, P403, P405, P410+403, P501[2] | ||||
(25 °C kaj 100 kPa) | |||||
Kloro-metano aŭ CH3Cl estas organika kemia komponaĵo el la halogena familio ankaŭ konata kiel halogenalkanoj. Ĝi estas ekstreme bruligebla gaso kun milda dolĉeca odoro. Pro zorgoj rilate al ĝia tokseco, ĝi preskaŭ ne estas komercebla al ordinaraj konsumantoj. Klorometano estis unue sintezita en la jaro 1835 de la francaj kemiistoj Jean-Baptiste Dumas (1800-1884) kaj Eugène-Melchior Péligot (1811-1890) bolantaj miksaĵon da metanolo, sulfata acido kaj natria klorido. Ĉi-metodo estas simila al tiu uzata en la hodiaŭaj tagoj.
La ĉefa uzo de klorometano estas en la produktado de silikonoj[3] per la Müller-Rochow metodo. En neorganika kemio ĝi uzatas kiel metiligagento donante eterojn de fenoloj, alkoholojn k celulozojn (metila celulozo) kaj kiel glaciigagento. Iam ĝi estis uzata en la produktado de plumba kvarmetilo. Aliaj uzoj estas en reakcioj de Friedel-Crafts por doni alkilbenzenojn, en la produktado de kvaternaraj amonio-saloj kaj metil-merkaptanoj. Klorido de metilo ankaŭ uzatas en la produktado de farmaciaĵoj.
Sintezoj
[redakti | redakti fonton]Sintezo 1
[redakti | redakti fonton]- Preparado de klorometano per agado de klorida acido sur metanolo:[4]
|
|
Sintezo 2
[redakti | redakti fonton]- Kvankam ĝi ne estas praktika maniero produkti klorometanon en laboratorio, la sekva ekvacio inter metano kaj kloro estas teorie ebla:[5][6] Tamen, tiu reakcio estas nur interesa en la produktado de kloroformo pro tio ke la klorometano produktita reakcias kun la eksceso de kloro por formi dukloro-metanon, kiu, cetere reakcias kun pli da kloro por finfine produkti la kloroformon.
|
|
Reakcioj
[redakti | redakti fonton]Reakcio 1
[redakti | redakti fonton]- Kiel metiligagento, klorido de metilo povas reakcii kun acidoj por doni esterojn:
Reakcio 2
[redakti | redakti fonton]- Iu materialo necesa por fari silikonojn estas dukloro-dumetil-silano (aŭ [CH3]2SiCl2). Ĝi estas farita per traktado de silicia pulvoro ĉirkaŭ 300 °C en ĉeesto de kupro-enhava katalizilo:[7]
Reakcio 3
[redakti | redakti fonton]- Tolueno estas tiel malmultekosta industrie produktata ke ĝi ne estas preparata en laboratorioj. Principe ĝi povas esti preparata per pluraj metodoj, ekzemple, kvankam ĝi ne estas didaktike interesa, benzeno reakcias kun klorido de metilo en ĉeesto de acido de Lewis tia kia aluminia klorido por doni toluenon:
Literaturo
[redakti | redakti fonton]- American Society for Microbiology Arkivigite je 2018-11-11 per la retarkivo Wayback Machine
- CasLab Arkivigite je 2018-11-11 per la retarkivo Wayback Machine
- Chlorinated Organic Compounds in the Environment
- Drinking Water Health Advisory: Volatile Organic Compounds
- The Geochemistry of Stable Chlorine and Bromine Isotopes
- Toxicology Desk Reference
- Chlorine: Principles and Industrial Practice
Vidu ankaŭ
[redakti | redakti fonton]Referencoj
[redakti | redakti fonton]- ↑ Scottish Environment Protection Agency. Arkivita el la originalo je 2018-11-11. Alirita 2018-11-11.
- ↑ Pubchem
- ↑ Methane and its Derivatives
- ↑ Chlorine: Principles and Industrial Practice
- ↑ Organic Chemistry
- ↑ Organic Chemistry
- ↑ Chemistry and Chemical Reactivity







![{\displaystyle {\mathsf {\,H_{3}C-OH+\,HCl\,{\underset {}{\xrightarrow[{aktiva\,aluminio}]{280^{o}C-350^{o}C}}}\,CH_{3}Cl+H_{2}O}}}](http://178.128.105.246/host-https-wikimedia.org/api/rest_v1/media/math/render/svg/e15fe96f573a7f91db2970c5ec2a4ba71c920e8c)
![{\displaystyle {\mathsf {\,CH_{4}+Cl_{2}\,{\underset {}{\xrightarrow[{ultra\,viola\,lumo}]{440^{o}C}}}\,\,CH_{3}Cl+HCl}}}](http://178.128.105.246/host-https-wikimedia.org/api/rest_v1/media/math/render/svg/4a1a9b2ac3b58b3b4ee47a3da9f9d4fd63a73ec8)


![{\displaystyle {\mathsf {\,{\underset {}{\xrightarrow[{-HCl}]{}}}\,}}}](http://178.128.105.246/host-https-wikimedia.org/api/rest_v1/media/math/render/svg/4f4d23d5168ee72b21140d5a93aa29e59fab4324)

![{\displaystyle {\mathsf {\,{\underset {}{\xrightarrow[{}]{}}}\,}}}](http://178.128.105.246/host-https-wikimedia.org/api/rest_v1/media/math/render/svg/a62464c6b23d7dd48c7b161157fec5787e6d69c2)

![{\displaystyle {\mathsf {\,\,{\underset {}{\xrightarrow[{AlCl_{3}}]{}}}\,\,}}}](http://178.128.105.246/host-https-wikimedia.org/api/rest_v1/media/math/render/svg/af0d533b45b8eed1f0d4c4ae8aff95243a1eb9ef)