Lysozyme
| Lysozyme | ||
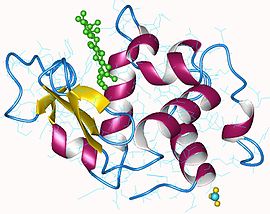 Lysozyme humain avec N-acétylglucosamine et mannose en vert (PDB 1REM[1]) | ||
| Caractéristiques générales | ||
|---|---|---|
| Nom approuvé | Lysozyme | |
| Symbole | LYZ | |
| N° EC | 3.2.1.17 | |
| Homo sapiens | ||
| Locus | 12q15 | |
| Masse moléculaire | 16 537 Da[2] | |
| Nombre de résidus | 148 acides aminés[2] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| Lysozyme Like 1 | ||
| Caractéristiques générales | ||
| Nom approuvé | Lysozyme Like 1 | |
| Symbole | LYZL1 | |
| N° EC | 3.2.1.17 | |
| Homo sapiens | ||
| Locus | 10p12.1 | |
| Masse moléculaire | 16 654 Da[2] | |
| Nombre de résidus | 148 acides aminés[2] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| Lysozyme Like 2 | ||
| Caractéristiques générales | ||
| Nom approuvé | Lysozyme Like 2 | |
| Symbole | LYZL2 | |
| N° EC | 3.2.1.17 | |
| Homo sapiens | ||
| Locus | 10p11.23 | |
| Masse moléculaire | 16 656 Da[2] | |
| Nombre de résidus | 148 acides aminés[2] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
Le lysozyme ou muramidase est une protéine globulaire longue d'une centaine d'acides aminés (130 chez l'être humain) qui est impliquée dans la défense contre les infections bactériennes. Elle est présente chez de nombreuses espèces d'animaux (vertébrés, insectes, acariens[3] et certains mollusques). On le trouve en particulier dans un certain nombre de sécrétions (larmes, salive, lait maternel, mucus...) et dans le blanc d'œuf (129 acides aminés chez la poule).
Il s'agit d'une glycoside hydrolase acide (EC 3.2.1.17) sécrétée par les granulocytes et les monocytes. Elle détruit la paroi bactérienne des bactéries à Gram positif en catalysant l'hydrolyse des peptidoglycanes la constituant. Cette propriété a incité certains auteurs[Qui ?] à la qualifier d'antibiotique corporel. De manière plus précise, le lysozyme est un des constituants de l'immunité innée.
Cette protéine a été découverte par Alexander Fleming en 1922.
Le lysozyme de blanc d'œuf (type-C) possède une saveur sucrée 200 fois plus intense que celle de la protéine édulcorante thaumatine (au seuil de perception)[4].
| N° EC | EC |
|---|---|
| N° CAS |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Mode d'action
[modifier | modifier le code]Le lysozyme peut agir comme une opsonine innée, ou comme une enzyme lytique capable de lyser des bactéries, en particulier celles à Gram positif, indépendamment de leur pouvoir pathogène. En revanche, les bactéries à Gram négatif sont généralement résistantes à cette enzyme grâce à la couche externe de lipopolysaccharides (LPS) qui les caractérise. Cette couche LPS couvre la paroi muréique (par exemple, une couche de peptidoglycanes) et la protège contre l'attaque par le lysozyme en empêchant l'accès de cette enzyme.
Le lysozyme sert d'opsonine non spécifique innée en se fixant à la surface bactérienne, réduisant ainsi la charge négative et facilitant la phagocytose de la bactérie avant que les opsonines du système acquis de l'immunité. En d'autres termes, le lysozyme facilite la phagocytose par les leucocytes.
Concernant la lyse bactérienne, l'enzyme attaque les peptidoglycanes constituant la paroi des bactéries (particulièrement les bactéries Gram positif). En effet, le lysozyme hydrolyse les liaisons covalentes (β1→4 glucosidique) entre l'acide N-acétyl-muramique et le 4e atome de carbone du N-acétyl-glucosamine[4]. La molécule de peptidoglycane se trouve associée avec le site de fixation de l'enzyme (binding site) situé dans un creux entre les deux domaines. Cela contraint la molécule de substrat à adopter la conformation de l'état de transition. Les acides aminés Glu 35 (acide glutamique, acide aminé numéro 35), et Asp 52 (acide aspartique, acide aminé numéro 52) se sont révélés être indispensables à l'activité enzymatique. La Glu 35 agit comme donneur de proton au pont glycosidique, clivant la liaison C-O du substrat, tandis que l'Asp 52 sert de nucléophile permettant la formation transitoire d'une enzyme glycosylée. Celle-ci réagit alors avec une molécule d'eau, donnant le produit final de l'hydrolyse et l'enzyme dans sa forme initiale.

Maladies liées au lysozyme
[modifier | modifier le code]Une mutation sur le gène du lysozyme peut être à l'origine de l'accumulation de protéines amyloïdes dans certains tissus.
Utilisation diagnostique
[modifier | modifier le code]Un taux accru de lysozyme dans le sang est souvent lié à une sarcoïdose. Des valeurs de 8 mg/L ou plus sont considérées comme élevées.
Références
[modifier | modifier le code]- (en) M. Muraki, K. Harata, N. Sugita et K. Sato, « X-ray Structure of Human Lysozyme Labelled with 2',3'-Epoxypropyl β-Glycoside of Man-β1,4-GlcNAc. Structural Change and Recognition Specificity at Subsite B », Acta crystallographica Section D – Structural Biology, vol. 54, no Pt 1, , p. 834-843 (PMID 9757098, DOI 10.1107/S090744499800122X, lire en ligne)
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- Lenka Grunclov, Hélène Fouquier, Václav Hyps et Petr Kopásek, Lysozyme from the gut of the soft tick Ornithodoros moubata: the sequence, phylogeny and post-feeding regulation ; Developmental & Comparative Immunology Volume 27, Issue 8, September 2003, Pages 651-660 doi:10.1016/S0145-305X(03)00052-1 (Résumé)
- (en) Masuda, T. & Kitabatake, Developments in biotechnological production of sweet proteins. J. Biosci. Bioeng. 2006, 102, 375–389