기하 이성질체


기하 이성질체(幾何異性質體, 영어: geometric isomer) 또는 시스-트랜스 이성질체(영어: cis-trans isomerism)는 유기화학에서 분자 안에서의 작용기의 방향에 따른 입체 이성질체(stereoisomer)의 한 형태이다. 영문으로는 cis-trans isomer 또는 geometric isomer 또는 configuration isomer 로 불리며 E-Z isomer 와 혼동해서는 안된다. 일반적으로 이러한 이성질체는 회전할 수 없는 이중 결합을 포함한다. 그러나 결합의 회전이 크게 제한되는 고리 구조 때문에 이성질체가 생기기도 한다. 기하 이성질체는 유기 분자에서 그리고 무기 배위착체(coordination complex)에서도 발생한다.
'시스(cis)', '트랜스(trans)'라는 용어는 라틴어에서 왔는데, '시스'는 "같은 면"이라는 뜻이고 '트랜스'는 "다른 면"이라는 뜻이다. IUPAC에서는 "Geometric isomer"(기하 이성질체)라는 용어를 "cis-trans isomer"(시스-트랜스 이성질체)의 구식 동의어로 간주한다.[1] 때때로 기하 이성질체는 일반적인 입체 이성질체를 가리키기도 한다.(예를 들면, 광학 이성질체를 기하 이성질체라고 부른다.) 비광학 입체 이성질체에 대한 정확한 용어는 부분입체 이성질체(diastereomer)이다.
유기화학에서의 기하 이성질체
[편집]치환기가 같은 방향을 향하면, 그 부분입체 이성질체는 '시스'라고 부르고, 치환기가 다른 방향을 향하면, 그 부분입체 이성질체는 '트랜스'라고 부른다. 시스-트랜스 이성질체의 예로는, 오른쪽에 보이는 저분자 탄화수소, 2-뷰텐(2-butene)이 있다.
지방족 고리화합물도 또한 시스-트랜스 이성질체가 있다. 고리 구조로 인한 이성질체의 예로서, 1,2-다이디클로로사이클로헥세인을 생각할 수 있다.
  |
 
|
| trans-1,2-dichlorocyclohexane | cis-1,2-dichlorocyclohexane |
물리적 성질의 비교
[편집]시스 이성질체와 트랜스 이성질체는 종종 다른 물리적 성질을 지닌다. 이성질체 간의 차이점은, 일반적으로 분자의 모양이나 분자의 쌍극자 모멘트의 차이 때문에 나타난다.
 |

|
| cis-2-pentene | trans-2-pentene |
 |

|
| cis-1,2-dichloroethene | trans-1,2-dichloroethene |
 |

|
| cis-butenedioic acid (maleic acid) |
trans-butenedioic acid (fumaric acid) |
 |
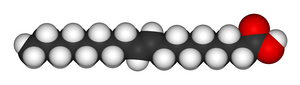
|
| Oleic acid | Elaidic acid |
직쇄 알켄의 끓는점과 같은 경우에는 이러한 차이는 매우 작다. 그 예로는 2-펜텐(2-Pentene)이 있는데, 시스 이성질체에서는 37 °C이고 트랜스 이성질체에서는 36 °C이다.[2] 극성 결합이 존재하면, 시스와 트랜스 이성질체 사이의 차이가 커진다. 그 예로는 1,2-디클로로에텐(1,2-dichloroethene)이 있는데, 시스 이성질체의 끓는점은 60.3 °C인 반면에 트랜스 이성질체의 끓는점은 47.5 °C이다.[3] 시스 이성질체에서는 두 개의 극성 C-Cl 결합 쌍극자 모멘트가 결합하여 분자 쌍극자 모멘트를 형성하여, 분자간 쌍극자-쌍극자 힘(또는 Keesom force)이 존재하게 되는데, 반 데르 발스 힘의 일종인 London dispersion force에 더해져 끓는점을 상승시킨다. 한편, 트랜스 이성질체에서는 두 개의 C-Cl 결합 모멘트가 상쇄되고 분자가 비극성이어서 이러한 현상이 일어나지 않는다.
1,2-에틸렌다이카복실산(butenedioic acid)의 두 이성질체는 성질과 반응성에서 상당히 큰 차이를 보여서, 이들은 실제로 완전히 다른 이름이 쓰였다. 시스 이성질체는 말레 산이고 트랜스는 푸마르 산이었다. 끓는점을 결정하는 요인은 극성인데, 극성이 분자간 힘을 증가시키고, 그로 인해 끓는점이 증가하기 때문이다. 같은 방식으로, 녹는점의 결정하는 요인은 대칭성인데, 대칭성이 클수록 더욱 작은 공간 안에 많은 분자가 결합고체 상태에서 더 잘 결합하기 때문이며, 극성이 변하지 않아도 결과는 같다. 그 예로서 올레 산과 엘라이드 산이 있다. 시스 이성질체인 올레 산의 녹는점은 13.4 °C로 실온에서 액체인 반면, 트랜스 이성질체인 엘라이드 산은, 치밀하게 결합할 수 있는 곧은 모양이기 때문에, 녹는점은 훨씬 높은 43 °C로 실온에서 고체이다.
따라서 극성이 약하고 더 대칭적인 트랜스 알켄이 낮은 끓는점과 높은 녹는점을 가지고, 극성이 강하고 덜 대칭적인 시스 알켄이 높은 끓는점과 낮은 녹는점을 가진다.
이중결합으로 인한 시스-트랜스 이성질체의 경우, 특히 두 개의 치환기가 같을 때, 몇 가지 일반적인 경향이 나타난다. 이 경향은 시스 이성질체의 치환기의 쌍극자가 분자 쌍극자 모멘트를 증가시킨다는 사실로부터 기인한 것이다. 트랜스 이성질체에서는 치환기가 분자의 반대쪽에 있기 때문에, 쌍극자 모멘트가 상쇄된다. 트랜스 이성질체도 또한 시스 이성질체보다 낮은 밀도를 갖는 경향이 있다.
March[4]는 트랜스 알켄은 일반적으로 시스 알켄보다 더 대칭적이고, 트랜스 알켄은 높은 녹는점과 불활성 용매에서 낮은 용해도를 가지는 경향이 있다는 것을 관측했다.
NMR 분광학에 의해 측정된 Vicinal coupling 상수(3JHH)는 트랜스의 경우(범위: 12-18Hz, 보통의 경우:15Hz)가 시스의 경우(범위: 0-12Hz, 보통의 경우: 8Hz)보다 크다.[5]
안정성
[편집]대개, 트랜스 이성질체는 시스 이성질체보다 안정적이다. 이는 부분적으로 분자 모양 때문이다. 트랜스 이성질체의 더욱 곧은 분자 모양이, 이성질체를 더욱 안정적이게 만드는 수소의 분자간 힘을 유발한다. Jerry March에 따르면, 트랜스 이성질체는 또한 낮은 연소열을 가지고, 높은 열화학적 안정성을 가진다. Benson의 Heat of formation group additivity에서, 시스 이성질체의 데이터 셋은 1.10 kcal/mol의 안정성 페널티를 받는다. 이 규칙에는 예외가 존재한다. 예를 들면, 1,2-디플루오로에틸렌(1,2-difluoroethylene, 1,2-difluorodiazene)(FN=NF)과 몇 개의 다른 halogen-substituted ethylene과 oxygen-substituted ethylene이 있다. 이러한 경우에는 시스 이성질체가 트랜스 이성질체보다 안정적이다.[6] 이러한 현상은 시스 효과(cis effect)라고 불린다.[7]
E/Z 표기법
[편집]
하나의 이중결합에 두 개 이상의 다른 치환기가 있는 경우에는, 이성질체를 명명하는 데에 있어 시스/트랜스 체계는 효과적이지 못하다. 그러한 경우에는 E/Z 표기법이 쓰여야 한다. Z(독일어 zusammen에서 유래함)는 같은 편(together)이라는 뜻으로 cis에 대응하고, E(독일어 entgegen에서 유래함)는 반대편(opposite)이라는 뜻으로 trans에 대응한다.
분자 구성이 E인지 Z인지는 칸-인골드-프렐로그 순위 규칙에 의해 결정된다(높은 원자 번호가 높은 우선순위를 가진다). 이중 결합한 두 원자 각각에 대해, 두 치환기 중에 어느 것이 높은 우선순위를 갖는지를 결정할 필요가 있다. 만약 높은 우선순위를 가지는 두 치환기가 같은 면에 있으면, 그 배열은 Z이고, 만약 다른 면에 있으면, 그 배열은 E이다.
무기 배위착체(coordination complex)
[편집]팔면체 또는 정사각평면 구조의 무기 배위착체에도, 비슷한 리간드가 가까이에 있는 시스 이성질체와 비슷한 리간드가 멀리 있는 트랜스 이성질체가 있다.

예를 들면, 1893년에 알프레트 베르너가 설명했듯이, 정사각평면의 Pt(NH3)2Cl2의 두 개의 이성질체가 있다. 정식 명칭이 cis-diamminedichloroplatinum(II)인, 시스 이성질체는 1969년에 로젠버그(Barnett Rosenberg)에 의해 항암 효과가 발견되어, 현재는 약칭, 시스플라틴이라는 화학요법 약물로 알려져 있다. 반면에, 트랜스 이성질체인 트랜스플라틴은 아무런 항암 효과가 없다. 각각의 이성질체는 트랜스 효과를 이용하여 합성될 수 있다.
화학식 MX4Y2을 가지는 팔면체 착체는 두 개의 이성질체가 존재한다. (여기서 M은 금속 원자이고 X와 Y는 서로 다른 두 종류의 리간드이다.) 시스 이성질체에서는 두 개의 Y 리간드가 서로에게 90o를 이루며 이웃에 위치하며, cis-[Co(NH3)4Cl2]+에서 녹색인 두 개의 염소 원자가 이에 해당한다. 오른쪽에 보이는 트랜스 이성질체에서는, 두 개의 염소 원자가 중앙의 Co 원자의 반대편에 위치한다.
 |

|
|---|---|
| 시스-[Co(NH3)4 Cl2]+과 트랜스-[Co(NH3)4 Cl2]+ | |
팔면체 착체 MX3Y3의 이성질체는 facial-meridional (또는 fac-mer) 이성질체에 해당하며, 다른 개수의 리간드가 서로에게 이웃한다.
같이 보기
[편집]각주
[편집]- ↑ “IUPAC Gold Book - geometric isomerism”. Goldbook.iupac.org. 2009년 9월 7일. 2010년 6월 22일에 확인함.
- ↑ “Chemicalland values”. Chemicalland21.com. 2010년 6월 22일에 확인함.
- ↑ CRC Handbook of Chemistry and Physics, 60th Edition (1979-80), p.C-298
- ↑ Advanced organic Chemistry, Reactions, mechanisms and structure 3ed. page 111 Jerry March ISBN 0-471-85472-7
- ↑ "Spectroscopic Methods in Organic Chemistry," Dudly H. WIlliams and Ian Fleming, 4th ed. revised,McGraw-Hill Book Company (UK) Limited, 1989.Table 3.27
- ↑ The stereochemical consequences of electron delocalization in extended .pi. systems. An interpretation of the cis effect exhibited by 1,2-disubstituted ethylenes and related phenomena Richard C. Bingham J. Am. Chem. Soc.; 1976; 98(2); 535-540 Abstract
- ↑ Craig, N. C.; Chen, A.; Suh, K. H.; Klee, S.; Mellau, G. C.; Winnewisser, B. P.; Winnewisser, M. (1997). "Contribution to the Study of the Gauche Effect. The Complete Structure of theAntiRotamer of 1,2-Difluoroethane". Journal of the American Chemical Society 119: 4789. doi:10.1021/ja963819e
