Compausat quimic

Lei compausats quimics son de substàncias quimicas puras compausadas d'atòms d'au mens dos elements quimics diferents. Leis atòms que constituisson aqueleis assemblatges son liats entre elei per de liames quimics (ionics, covalents...). Coma substància pura, lei compausats quimics an de proprietats fisicoquimicas caracteristicas que permèton de leis identificar. Pòdon èsser transformats per reaccion quimica en d'autrei compausats quimics.
Lei compausats quimics son l'objècte de classificacions variadas. La pus modèrna es aquela dau Chemical Abstracts Service qu'atribuís un numerò d'identificacion unica a cada preparacion quimica. Pasmens, per de rasons de comoditat, d'autrei classificacions contunian d'èsser utilizadas. La pus importanta es aquela que diferencia lei substàncias organicas (compausats a basa de carbòni e d'idrogèn) e lei compausats inorganics (lo rèsta).
Definicion
[modificar | Modificar lo còdi]
Tota substància quimica constituïda de dos ò de plusors tipes d'atòms diferents (elements quimics) dins una proporcion estequiometrica fixa pòu èsser dich « compausat quimic ». Aquela proporcion es exprimida dins la formula quimica. L'aiga, substància facha de dos atòms d'idrogèn e d'un atòm d'oxigèn, a per exemple, la formula bruta H2O. De mai, aquelei compausats an una estructura quimica unica e definida qu'es mantenguda en plaça per una organizacion espaciala deis atòms que son liats entre elei per de liames quimics. Lei proprietats fisicquimicas d'aqueleis estructuras son caracteristicas e pòdon permetre l'identificacion d'un produch pur gràcias a la mesura de certanei paramètres. Per exemple, un ponch de fusion a 0 °C e un ponch d'ebulicion a 100 °C sota una pression de 1 atm son de proprietats pròprias a l'aiga. En causa d'aquela proporcion clarament definida, aquelei compausats pòdon èsser convertits, per reaccion quimica, per formar d'autrei compausats.
De règlas de nomenclatura son estadas definidas per lei societats de quimistas per identificar pus aisament lei diferents compausats. La principala, fòrça utilizada per lei substàncias organicas, es aquela de l'Union Internacioanala de Quimia Pura e Aplicada (IUPAC). Existís tanben lo numerò CAS, gerit per lo Chemical Abstracts Service, que permet de definir una numerò d'identificacion unic per cada produch o preparacion quimic.
Classificacions
[modificar | Modificar lo còdi]Classificacion segon lo tipe de liame
[modificar | Modificar lo còdi]La natura dau liame quimic que permet d'unic leis atòms d'un compausat es un premier critèri permetent de definir tres categorias principalas :
- lei liames ionics son de liames fòrts que resultan de la pèrda o dau gasanh d'un o de plusors electrons per un atòm. Dins lo cas d'una pèrda, l'atòm vèn un ion cargat positivament (cation) e dins lo cas contrari, vèn un ion cargat negativament (anion). Aqueu tipe de liame s'establís generalament quand i a una gròssa diferéncia d'electronegativitat entre lei dos atòms (mai de 1,7 sus l'escala de Pauling).
- lei liames covalents son de liames fòrts que resultat que partiment d'electrons per dos atòms afin de crear un pareu d'electrons liants. Aqueu tipe de liame s'establís generalament quand la diferéncia d'electronegativitat entre lei dos atòms es febla o moderada (mens de 1,7 sus l'escala de Pauling).
- lei liames metallics son de liames fòrts qu'asseguran la coesion dei metaus. En premiera aproximacion, leis electrons se desplaçan liurament entre lei cations que forman lo ret cristallin.
- lo liame covalent de coordenacion es un liame onte leis electrons permetent l'establiment dau liame vènon d'una entitat unica dicha ligand.
Compausats organics e inorganics
[modificar | Modificar lo còdi]Fins a la sintèsi de l'urèa realizada per Friedrich Wöhler (1800-1882) en 1828, lei quimistas supausavan l'existéncia d'una separacion clara entre lei compausats presents dins leis organismes vivents e lo rèsta dei substàncias conegudas. Aquela teoria foguèt a l'origina dei tèrmes « quimia organica », que s'interessava a l'estudi dei compausats dau premier grop, e « quimia inorganica », cargada de la recèrca sus lo segond. Pasmens, lei trabalhs de Wöhler mostrèron lo caractèr erronèu d'aquela distincion, çò que durbiguèt la via a la recèrca sus lei compausats sintetics.
Se la separacion es uei considerada coma caduca per l'ensemble de la comunautat scientifica, es conservada per l'usatge. D'efiech, lei dos domenis son pauc mesclats dins leis aplicacions de la quimia modèrna. Per de rasons de simplificacion, l'ensenhament a tanben gardat la separacion.
Compausats naturaus, sintetics e artificiaus
[modificar | Modificar lo còdi]Un autre distincion tradicionau de la quimia es basat sus l'origina dei compausats quimics e sus sa preséncia dins la natura :
- lei compausats naturaus son lei substàncias dirèctament eissidas d'un procès naturau. Per exemple, es lo cas de la vanillina qu'es extracha de la vanilha naturala.
- lei compausats sintetics son lei substàncias, presentas dins la natura, que son obtengudas per un procès quimic uman. Lei produchs naturaus e sintetics son identics e es impossible de lei diferenciar[1]. Un exemple es la vanillina industriala.
- lei compausats artificiaus son lei substàncias produchas en laboratòri o per l'industria quimica qu'existisson pas dins la natura. Es lo cas d'un nombre important de medicaments.
Classificacion per estructura
[modificar | Modificar lo còdi]
Es possible de classar lei compausats per la natura de son estructura. Dins aqueu cas, son estudiats la preséncia de cicles, lo nombre d'atòms dins aquelei cicles, la preséncia de liames quimics dobles o triples, la preséncia de liames de coordenacion... Aqueleis observacions son importantas car permèton generalament d'identificar lei sites reactius dei compausats.
Classificacion per grops foncionaus
[modificar | Modificar lo còdi]Aqueu tipe de classificacion es principalament utilizat en quimia organica ont es tradicionau. Pasmens, de còps, pòu s'observar en quimia inorganic onte de familhas de substàncias existisson tanben. D'exemples de grops foncionaus organics son donats dins lo tablèu aicí dessota :
Descripcion dei grops principaus de compausats organics
[modificar | Modificar lo còdi]Idrocarburs
[modificar | Modificar lo còdi]Leis idrocarburs son de compausats fachs d'atòms de carbòni e d'idrogèn. Son de natura variada e existís mai d'un sistèma de classament :
- leis idrocarburs saturats an una cadena carbonada unicament constituïda de liames quimics simples (alcans...).
- leis idrocarburs insaturats an una cadena carbonada amb au mens un liame doble o triple (alcèns, alcins, aromatics...).
- leis idrocarburs aciclics son fachs de brancas linearas.
- leis idrocarburs aliciclics an un cicle compausat de liames quimics simples (cicloexan...).
- leis idrocarburs aromatics (benzèn...).
La màger part deis idrocarburs son d'origina naturala e son produchs per l'industria petroliera. Pasmens, existís de reaccions que permèton de preparar d'idrocarburs a partir d'autrei compausats organics e de catalizaires especiaus. Lei pus frequents son la reaccion de Wurtz, la reaccion de Wolff-Kishner e la reduccion de Clemmensen.
D'idrocarburs pòdon s'utilizar dirèctament coma combustible (metan, etan...), carburant (octan...) o solvent (benzèn...). D'autrei, generalament pus complèxs, pòdon servir de reactius dins de procès de sintèsi de moleculas sinteticas (medicaments...).
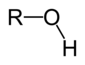
Alcòls
[modificar | Modificar lo còdi]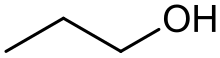
Leis alcòls son de compausats organics que se caracterizan per la preséncia d'un grop –OH liat a un atòm de carbòni tetravalent. Lei règlas de nomenclatura li atribuisson lo sufix « -òl ». Se parla d'alcòl primari, segondari e terciari s'un, dos o tres radicaus son estacats a l'atòm de carbòni. Certaneis alcòls simples pòdon s'obtenir per la transformacion de sucres durant de reaccions de fermentacion. Lei pus complèxs son sintetizats per idratacion d'idrocarburs eissits dau rafinatge dau petròli.
Leis alcòls son de moleculas utilizadas dins mai d'una sintèsi organica. D'efiech, sei proprietats acidobasicas e nucleofilas permèton de realizar una gama larga de reaccions coma de substitucions nucleofilas (permetent de produrre d'idrocarburs alogenats), de reaccions de desidratacion (permet de produrre d'alcèns) e de reaccions d'esterificacion. Es tanben possible d'oxidar un alcòl per formar un acid carboxilic.
Etèrs
[modificar | Modificar lo còdi]
Leis etèrs son son de compausats organics de formula generala R–O–R' amb R e R' de grops alquil. Lei règlas de nomenclatura li atribuisson lo sufix « -il » qu'es apondut a la racina eissida dau nom de l'alcan correspondent. Dins lei condicions normalas de temperatura e de pression, leis etèrs son sovent de liquids volatils. Existís tres procès principaus per lei sintetizar a partir de reaccions sus d'alogenoalcans (sintèsi de Williamson ò substitucion nucleofila SN1 entre un alogenoalcan e un alcòl) o a partir de la desidratacion d'un alcòl.
La polarizacion dau liame quimic C–O e lei doblets non liants sus l'atòm d'oxigèn dònan una reactivitat importanta ais etèrs que son sovent considerats coma de substàncias instablas :
- la rompedura dau liame C–O es obtenguda en preséncia d'un compausat permetent d'estabilizar lo grop R–O–. Per exemple, es lo cas d'un alogenoalcan. Aquela dificultat – relativa – per obtenir la partença dau grop R–O permet d'utilizar la fabricacion d'etèrs per protegir de foncions alcòl.
- lei doblets de l'atòm d'oxigèn e lor reactivitat permèton l'aparicion de proprietats de basa de Brønsted e de Lewis.
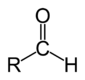
Aldeïds
[modificar | Modificar lo còdi]
Leis aldeïds son una familha de compausats organics, de formula generala R–C(H)=O, que son de derivats d'alcòls. La nomenclatura li dònan lo sufix « -al » que remplaça lo sufix « -òl » de l'alcòl d'origina. Son obtenguts per oxidacion d'alcòls primaris. Dins l'industria, l'oxidant principau es lo dioxigèn e l'usatge de catalisaires es necessari. Un caufatge entre 400 e 600 °C es requist. En laboratòri, se pòdon utilizar d'oxidants « doç » que permèton de melhorar lo mestritge de la sintèsi (dicromat de potassi, reactiu de Sarett...).
Es egalament possible d'obtenir d'aldeïds a partir d'alcèns segon dos autrei procès :
- lo procès oxo permet de tractar d'alcèns, en preséncia de monoxid de carbòni, per obtenir d'aldeïds amb una cadena principala de 3 a 19 atòms de carbòni. Una aumentacion de la pression (10 a 100 bars), de la temperatura (40 a 200 °C) e un catalizaire son necessaris.
- lo procès d'ozonolisi qu'es basat sus la reaccion d'alcèns e d'ozòn en preséncia d'un reductor coma lo dimetilsulfur.
Leis aldeïds son de substàncias importantas en sintèsi organica. Son implicats dins l'acetalisacion (produccion d'un diòl), dins una reaccion amb un reactiu de Grignard (obtencion d'un alcòl segondari), dins la reaccion de Wittig (transformacion d'una liason C=O en C=C) e dins de reaccions de reduccion coma la reduccion de Clemmensen o la reduccion de Wolff-Kishner.
Cetonas
[modificar | Modificar lo còdi]
Lei cetonas son un grop de substàncias organicas, de formula generala R–CO—R', que son de derivats d'alcòls. Lei règlas de nomenclatura li atribuisson lo sufix « -ona » que remplaça lo sufix « -òl » de l'alcòl d'origina. Son obtengudas per oxidacion d'un alcòl segondari. Dins l'industria, s'utiliza lo dioxigèn, de procès de desidrogenacion catalitica o lo procès de Wacker-Hœchst. De caufatges e de catalizaires son totjorn necessaris. En laboratòri, de metòdes pus doç pòdon èsser més en òbra coma l'oxidacion per lo dicromat de potassi, per lo reactiu de Jones o per lo reactiu de Sarett. Es egalament possible de sintetizar de cetonas gràcias a l'ozonolisi d'alcèns (en utilizant un reductor), a l'idrolisi d'alcins en preséncia d'un catalizaire a basa de mercuri o a la reaccion de Friedel-Crafts sus un compausat aromatic.
Lei cetonas son d'intermediaris de sintèsi utils car pòdon participar a un nombre fòrça important de reaccions :
- l'acetalisacion amb dos alcòls per produrre un diòl.
- la reaccion amb un reactiu de Grignard per formar un ion alcoolat terciari.
- la reaccion de Wittig que permet de transformar un liame doble C=O en liame doble C=C.
- la reaccion de Shapiro onte son utilizadas per sintetizar lei reactius necessaris a la reaccion ela meteissa.
- de reaccions de reduccion amb lo diidrogèn (per produrre un alcòl).
- d'autrei reaccions de reduccion coma la reduccion de Clemmensen o la reduccion de Wolff-Kishner.
- d'addicions nucleofilas amb d'idrurs per produrre d'ions alcoolat.
- la cetolisacion que designa la condensacion de doas cetonas.
- l'oxidacion de Baeyer-Villiger que permet de transformar una cetona en estèr.
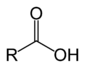
Acids carboxilics
[modificar | Modificar lo còdi]
Leis acids carboxilics son una familha de compausats organics, de formula generala R–COOH, derivats deis alcòls. Lei règlas de nomenclatura li atribuisson lo sufix « -oïc » que remplaça lo sufix « -òl » de l'alcòl d'origina. Lo nom es precedit per lo tèrme « acid ». Existís plusors metòdes possibles per obtenir d'acids carboxilics :
- oxidar un alcòl, un aldeïd o un alcèn.
- idrolizar un estèr (saponificacion) o un nitril.
- faire reagir un reactiu de Grignard e de dioxid de carbòni.
- realizar una sintèsi malonica.
Leis acids carboxilics pòdon reagir a partir :
- dei doblets non liats situats sus seis atòms d'oxigèn (basa de Lewis).
- dau carbòni centrau qu'a de proprietats electrofilas.
- de l'atòm d'idrogèn qu'es acid.
Estèrs
[modificar | Modificar lo còdi]
Leis estèrs son de compausats organics derivats d'un acid carboxilic. Son caracterizats per un grop format d'un atòm de carbòni liat per un liame doble a un atòm d'oxigèn e per un liame simple a un grop alquoxi. La representacion generala d'un estèr es de tipe R-COO-R'[2]. Lei règlas de nomenclatura destrian dos cas :
- se lo grop estèr es prioritari, la cadena principala (aquela de l'acid carboxilic) remplaça lo sufix « -oïc » de l'acid per « -oata » e la cadena segondària reçaup lo sufix « -il ».
- se lo grop estèr es pas prioritari, existís dos cas :
- lo prefix « R-oxicarbonil- » permet d'indicar un liame establit per lo grop carbonil amb la cadena principala.
- lo prefix « aciloxi- » permet d'indicar un liame establit per l'oxigèn.
Lo metòde de sintèsi pus frequent deis estèrs es la reaccion d'esterificacion entre un acid carboxilic e un alcòl. Pasmens, es lenta e reversibla. D'autrei reaccions foguèron donc cercadas. Lei pus eficaç remplaçan l'acid per un clorur d'acil o un anidrid d'acid.
Leis estèrs son fòrça utilizats per sei proprietats odorosas. Per exemple, l'etanoat de butil es conegut per son odor de banana. Un autre interès deis estèrs es lor capacitat de reagir amb una basa fòrta per fabricacion de sabon.
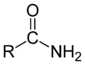
Amidas
[modificar | Modificar lo còdi]
Leis amidas son de compausats organics derivats d'un acid carboxilic. Son caracterizadas per la preséncia d'un atòm d'azòt liat a un grop carbonil. Per leis amidas aciclicas, lei règlas de nomenclatura li atribuisson lo nom de l'acid carboxilic correspondent amb lo remplaçament dau sufix « -oïc » per la terminason « -amida ». Per leis amidas ciclicas, lo nom es aqueu de l'alcan ciclic precedit per lo prefix « aza- » e acabat per lo sufix « -ona ».
Leis amidas son generalament sintetizadas a partir de l'acid carboxilic o de l'amina correspondents. Leis equilibris son pauc favorables a la formacion deis amidas e es donc necessari de trobar un mejan per lo desplaçar. Une tecnica frequenta consistís a « activar » l'acid amb una etapa que permet de lo transformar en clorur d'acil. L'utilizacion d'un anidrid d'acid es tanben un metòde simple que permet d'obtenir una amida gràcias a una reaccion amb una amina.
La reactivitat deis amidas es febla. Per lei faire reagir, es generalament necessari de lei caufar o d'utilizar un catalizaire poderós per lei redurre per tornar formar l'acid carboxilic e l'amina. La formacion d'una amida a donc un interès per protegir de foncions quimicas durant una sintèsi complèxa.
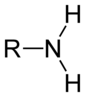
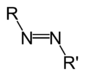
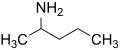
Aminas
[modificar | Modificar lo còdi]Leis aminas son de compausats organics derivats de l'amoniac. Son eissits de la partença d'un atòm d'idrogèn e de son remplaçament per un grop carbonat. Descubèrtas en 1849 per lo quimista francés Charles Adolphe Wurtz (1817-1884), foguèron inicialament dichas « alcaloïds artificiaus ». Lei règlas de nomenclatura li atribuisson lo sufix « -amina » se lo grop amina es prioritari es lo prefix « amino- » dins lo cas contrari. Se parla d'amina primària, segondària o terciària s'un, dos o tres radicaus son liats a l'atòm d'azòt. Existís tanben d'aminas aromaticas e alifaticas.
| Amina primària | Amine segondària | Amine terciària |
|---|---|---|
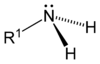 |
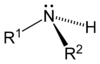 |
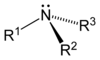 |
Leis aminas son generalament obtengudas per alquilacion d'aminas de reng inferior : l'alkilacion de l'amoniac permet d'obtenir una amina primària que pòu èsser alquilada en amina segondària que pòu èsser alquilada en amina terciària. La perseguida de l'alquilacion mena a la formacion d'un sau d'amonium quaternari.
L'atòm d'azòt es a l'origina dei proprietats quimicas deis aminas. D'efiech, aquel atòm a un doblet non liant, çò que conferís a la molecula un caractèr basic e nucleofil. De mai, dins lo cas deis aminas primàrias e segondàrias, lo liame N–H pòu se rompre. Aqueleis aminas presentan donc una aciditat febla que li permet de reagir amb de basas fòrtas coma leis organomagnesians.
-
Representacion de la metilamina.
-
Representacion dau 2-aminopentan
Descripcion dei grops principaus de compausats inorganics
[modificar | Modificar lo còdi]Idrurs
[modificar | Modificar lo còdi]L'ion idrur correspond a l'anion idrogèn H–. Per extension, lo tèrme « idrur » designa un compausat quimic format d'idrogèn e d'un element quimic mens electronegatiu. Existís plusors tipes diferents d'idrurs. Lei pus utilizats en quimia son leis idrurs ionics (o idrurs salins) que son utilizats per produrre de basas fòrtas (NaH, CaH2). Pasmens, i a egalament d'idrurs covalents sovent volatils, d'idrurs metallics que son l'objècte de recèrcas per i estocar d'idrogèn e d'idrurs polimerizats.
Oxids
[modificar | Modificar lo còdi]
Leis oxids son de compausats inorganics entre l'oxigèn e un element mens electronegatiu. Contèn donc teoricament l'anion O2-. Son de substàncias frequentas. Per exemple, un nombre important de mineraus terrèstres son d'oxids coma lo corindon (oxid d'alumini). La natura de l'oxid varia segon l'element associat amb l'oxigèn. Pòu èsser moleculara (aiga, dioxid de carbòni...) o cristallina (oxid de calci...).
Una proprietat importanta deis oxids es sa capacitat de reagir amb l'aiga per formar d'acids. Aqueu caractèr aumenta amb l'electronegativitat de l'element associat amb l'oxigèn. Lo cas pus extrèm es aqueu de l'acid percloric e son pKa de -8. Dins lo sens invèrs, d'elements pauc electronegatius entraïnan la formacion de basas fòrtas coma l'oxid de sòdi Na2O que sa reaccion amb d'aiga permet de produrre de soda NaOH.
Leis oxids son tanben ben presents en metallurgia. D'efiech, coma la màger part dei metaus fòrman aisament d'oxids en preséncia de dioxigèn, una etapa de crematge a sovent luòc au començament d'un procès de preparacion d'un metau. Permet d'oxidar lo minerau iniciau que contèn sovent de sulfats, de carbonats o d'autrei compausats ionics. L'interès es que la metallurgia deis oxids es ben mestrejada, çò que facilita leis etapas seguentas dau procès. En revènge, la formacion simpla d'un oxid pòu venir un problema se l'oxid es pauc solid. Lo cas pus conegut es aqueu deis oxids de fèrre que desgradan pauc a pauc lo metau, çò que necessita la fabricacion d'aliatges especiaus o la mesa en plaça de proteccion.
Acids inorganics
[modificar | Modificar lo còdi]Leis acids inorganics son de compausats susceptibles d'entraïnar la liberacion d'un proton (definicion de Bronsted) o d'acceptar un doblet d'electrons (definicion de Lewis). Son de compausats fòrça importants de la quimia en causa de sa reactivitat. Son definits doas familhas principalas d'acids inorganics :
- leis idracids an ges d'oxigèn dins son estructura moleculara. Son generalament d'idrurs d'elements non metallics coma un alogèn. Lo liame quimic entre l'idrogèn acid e lo rèsta de la molecula es sovent polarizat, çò que facilita sa rompedura. D'exemples d'idracids son l'acid fluoridric HF, l'acid cloridric HCl o lo sulfur d'idrogèn H2S.
- leis oxoacids an un atòm d'oxigèn dins sa molecula. Son generalament lo resultat de l'idratacion d'un oxid. Lor formula de basa es HxXOy amb X un element quimic. Dins una tala configuracion, la preséncia de l'oxigèn polariza lei liasons quimicas que pòdon aisament se rompre. D'exemples d'oxoacids son l'acid boric H3BO3, l'acid cloric HClO3 o l'acid sulfuric H2SO4.
Idroxids
[modificar | Modificar lo còdi]Leis idroxids son de compausats inorganics que contènon l'anion HO–, generalament liat a un cation metallic. Fòrça presents dins l'environament terrèstre, aquelei substàncias pòdon aisament formar de basas en causa de la polarizacion dau liame entre l'anion HO– e lo rèsta de la molecula. L'exemple pus conegut es l'idroxid de sòdi (o soda) NaOH qu'es una basa fòrta utilizada dins mai d'una aplicacion industriala.
Saus
[modificar | Modificar lo còdi]Lei saus son de compausats ionics de cations e d'anions que forman un produch neutre e sensa carga electrica clara. Aqueleis ions son generalament mineraus mai existís d'ions organics susceptibles de participar a la formacion de saus coma leis ions acetats CH3COO–. Lei solucions de saus dins l'aiga son dichas electrolits. Conductritz de l'electricitat, an d'aplicacions importantas en metallurgia car permèton sovent de melhorar la puretat.
Segon la formula generala e lei proprietats dau sau, son definits :
- lei saus simples que son lo resultat de l'associacion d'un cation eissit d'una basa e d'un anion eissit d'un acid. L'exemple pus conegut es lo clorur de sòdi NaCl.
- lei saus acids contènon d'atòms d'idrogèn acids. Un exemple es l'idrogenocarbonat de sòdi NaBCO3.
- lei saus multiples (dobles, triples...) son eissits de la solidificacion de solucions contenent de mesclas d'ions.
Complèxs
[modificar | Modificar lo còdi]
Un complèx es un compausat poliatomic format d'un o de plusors entitats independentas (ions o moleculas) en interaccion. Es sovent constituït d'un cation metallic enviroutat per de compausats anionics o neutres, dichs ligands, que deslocalizan una partida de lor densitat electronica sus lo compausat centrau. L'estudi dei complèxs es importanta en quimia deis organometallics o en bioquimia car son frequents dins lei solucions aigassosas.
Organometallics
[modificar | Modificar lo còdi]Leis organometallics son una familha de compausats fòrça importants en sintèsi. Son caracterizats per la preséncia d'un liame covalent entre un atòm de carbòni e un atòm metallic. Lo carbòni pòu faire partida d'una molecula inorganica, coma lo monoxid de carbòni, mai generalament es liat a un idrocarbur. Lei metaus son variats mai lei pus importants son lo magnèsi, lo liti, lo coire, lo zinc, l'estanh, lo bòr e lo silici. Existís tanben d'organometallics contenent un atòm de coire e un atòm de liti.
Legislacion
[modificar | Modificar lo còdi]Fòrça compausats quimics pòdon aver d'efiechs positius o negatius sus la santat o l'environament. Per aquela rason, son l'objècte de reglementacions particularas regardant lor produccion, lor transpòrt, lor venda, lor transformacion, lor etiquetatge, lor reciclatge e lor eliminacion. Dins l'Union Europèa, aqueu quadre es definit per la directiva REACH que prevetz tanben l'organizacion d'assais per determinar la toxicitat de cada substància. Pasmens, d'autrei reglementacions importantas existisson coma l'ADR que precisa lo quadre generau per lo transpòrt de produchs quimics dins lo mond o coma lei règlas de seguretat professionala que determina lei mejans de proteccion de metre en plaça dins una entrepresa.
Annèxas
[modificar | Modificar lo còdi]Liames intèrnes
[modificar | Modificar lo còdi]Bibliografia
[modificar | Modificar lo còdi]- G. Chabot, J.-L. Riendeau et coll. (Zumdahl, S. S. and S. A.), Chimie Générale 3ème édition (Chemistry 7th édition ), Éditions CEC Quebecor Media (Houghton Mifflin Company), 2007.
- G. Chabot, J.-L. Riendeau et coll. (Zumdahl, S. S. and S. A.), Chimie des solutions 3ème édition (Chemistry 7th édition ), Éditions CEC Quebecor Media (Houghton Mifflin Company), 2007.
- Robert Siegfried, From elements to atoms: a history of chemical composition, American Philosophical Society, 2002.
Nòtas e referéncias
[modificar | Modificar lo còdi]- ↑ Aquò es verai per un compausat unic. Pòu èsser faus dins lo cas d'una mescla de produchs car lei procès industriaus son sovent mens precís que lei procès naturaus.
- ↑ Pasmens, totei leis oxoacids organics e inorganics an la possibilitat de crear un estèr e existís d'estèrs amb d'atòms d'azòt (estèrs nitrics), de fòsfor (estèrs fosforics)...
Liames extèrnes
[modificar | Modificar lo còdi]- Publicacions ONU sus los produits quimics
- [1]. Lo registre CAS conten mes de 50 milions de compausats.
- Chemfinder
- R&D Chemicals
- ChemIDplus
- PubChem
- Material Data Safety Sheets