Roztwór stały
Roztwór stały – ciało stałe, które jest jednorodną pod względem fizycznym fazą krystaliczną, zawierającą dwa lub więcej składników, np. dwa lub więcej rodzajów jonów metali w sieci krystalicznej. Taką fazę nazywa się roztworem stałym, jeżeli po dodaniu substancji rozpuszczonych do dominującego składnika (rozpuszczalnika) typ struktury krystalicznej nie zmienia się, a parametry sieci zmieniają się stopniowo, wraz ze wzrostem stężenia substancji rozpuszczonych[1][2].
Badania struktury roztworów stałych oraz przemian, który ulegają, wchodzą w zakres:
- metaloznawstwa (roztwory w sieciach krystalicznych z wiązaniami metalicznymi)
- mineralogii (roztwory stałe w kryształach z wiązaniami jonowymi)
Rodzaje roztworów stałych
[edytuj | edytuj kod]
Wyodrębnia się roztwory stałe[1][2]:
- pierwszego rodzaju (substytucyjne, podstawieniowe, różnowęzłowe)
- drugiego rodzaju (addycyjne, międzywęzłowe, śródwęzłowe)
- trzeciego rodzaju (pustowęzłowe, deficytowe; stopy substrakcyjne)
Roztwory pierwszego rodzaju
[edytuj | edytuj kod]Roztwory pierwszego rodzaju powstają wówczas, gdy składniki rozpuszczone są izomorficzne z rozpuszczalnikiem (osnową) – mają budowę podobną w takim stopniu, że może powstać jedna faza krystaliczna o zmiennym składzie chemicznym. Wspólna krystalizacja dwóch substancji A i B w całym zakresie ich stężeń (tworzenie roztworów stałych ciągłych) jest możliwe tylko w przypadku, gdy spełnione są tzw. reguły Hume’a-Rothery’ego – oba składniki mają[1]:
- taką samą strukturę krystaliczna,
- podobne promienie atomowe/jonowe (różnica < 15%),
- podobną elektroujemność,
- podobną wartościowość.
Parametry sieci krystalicznej roztworu (np. wymiary komórki elementarnej) zmieniają się stopniowo wraz ze wzrostem zawartości A w B lub B w A.



Jeżeli wymienione kryteria Hume’a-Rothery’ego nie są spełnione, ze wzrostem udziału obcych atomów w węzłach sieci bardzo szybko rosną naprężenia wiązań. Dochodzi do sytuacji, w której dalszy wzrost stężenia nie jest możliwy w danych warunkach – powstaje roztwór stały graniczny (nasycony).
Wzajemna rozpuszczalność często ulega zmianom wraz ze zmianami temperatury. W czasie chłodzenia roztworów, otrzymanych w wysokiej temperaturze, może być osiągany stan nasycenia (granica termodynamicznej trwałości fazy). W czasie dalszego chłodzenia składnik rozpuszczony może[1]:
- wydzielać się z roztworu, tworząc drobne kryształy nowej fazy, wewnątrz ziaren rozpuszczalnika lub na ich powierzchni (zarodkowanie, utwardzanie dyspersyjne, przemiana fazowa dyfuzyjna)
- pozostawać w sieci krystalicznej rozpuszczalnika, powodując jej znaczne zdefektowanie (przesycone roztwory stałe).
W sieciach roztworów stałych I rzędu mogą powstawać różne rodzaje faz międzymetalicznych („związków międzymetalicznych”) – ziarna lub fragmenty ziarna (domeny) o takim rozmieszczeniu składników roztworu, które umożliwia osiągnięcie niższej energii swobodnej. Produktami przemian porządek–nieporządek mogą być różne rodzaje faz międzymetalicznych, oznaczanych literami alfabetu greckiego, np. [1][3]:
- nadstruktury (domeny lokalnego uporządkowania składników)
- fazy Lavesa (jony uporządkowane zgodnie z zasadą największego upakowania kul o różnych wymiarach)
- fazy Hume’a Rothery’ego (fazy β, γ i ε, o określonym „stężeniu elektronowym”, czyli stosunku liczby elektronów do liczby atomów równym odpowiednio: 21/14, 21/13 i 21/12)
Struktura otrzymanych stopów (np. liczba faz, wielkość i kształt ziaren, ich wzajemne rozmieszczenie, liczba defektów sieci krystalicznej) zależą od szybkości chłodzenia. Jest to podstawą procesów obróbki cieplnej (np. obróbka cieplna stopów żelaza)[1].
Roztwory drugiego rodzaju
[edytuj | edytuj kod]Roztwory drugiego rodzaju (addycyjne, międzywęzłowe, śródwęzłowe) powstają w przypadku braku izomorfizmu oraz wtedy, gdy wielkość przestrzeni międzywęzłowych, tzw. luk, umożliwia ulokowanie w nich atomów lub jonów substancji rozpuszczonej. Ze względu na mały rozmiar luk mieszczą się w nich tylko niewielkie atomy, np. wodoru, boru, węgla czy azotu. Ekspansja sieci spowodowana dodatkowymi atomami uniemożliwia powstawanie roztworów ciągłych roztwory międzywęzłowe są zawsze roztworami granicznymi. Takie roztwory powstają np. w czasie procesów obróbki cieplno-chemicznej stopów żelaza, tj. nawęglania lub azotowania[1][4].
Roztwory trzeciego rodzaju
[edytuj | edytuj kod]W roztworach trzeciego rodzaju (pustowęzłowe, deficytowe; stopy substrakcyjne) rolę rozpuszczalnika odgrywa uporządkowany roztwór stały (nadstruktura), którego chemiczny skład zależy od liczby pustych węzłów sieci; w przypadku stopów metali rozpuszczalnikiem jest tzw. faza międzymetaliczna (nazywana również „związkiem międzymetalicznym”), której chemiczny skład zmienia się w wąskim zakresie[1].
Od mechanizmu powstawania roztworu stałego zależy osiągalne stężenie substancji rozpuszczanej oraz właściwości materiału, np. mechaniczne i elektryczne. W przypadku metali od rodzaju sieci krystalicznej i stopnia jej zdefektowania zależą mechaniczne właściwości stopów, np. wytrzymałość, twardość, kruchość, sprężystość, plastyczność[1][5].
Możliwości modyfikowania elektrycznych właściwości materiałów są wykorzystywane w czasie wytwarzania półprzewodników (zmiany przewodnictwa wskutek domieszkowania)[1].
Roztwory stałe w metalurgii
[edytuj | edytuj kod]Kryształy roztworów stałych występują powszechnie w stopach metali, zarówno w stopach żelaza z węglem, jak w metalach nieżelaznych – ciężkich wysokotopliwych (np. chrom, nikiel), niskotopliwych (np. cynk, kadm, cyna), metali lekkich (np. beryl, magnez, glin) lub szlachetnych (np. złoto, srebro, platyna). Poniżej przedstawiono informacje dotyczące roztworów stałych występujących w strukturze stopów miedzi oraz stopach Fe–C[1].
Stopy miedzi z cyną, cynkiem i niklem
[edytuj | edytuj kod]




Spośród metali kolorowych (np. stopy miedzi, stopy aluminium, stopy cynku) wyróżniają się stopy miedzi z cyną i cynkiem, czyli brązy i mosiądze. Stopy miedzi z innymi dodatkami stopowymi, takimi jak glin, beryl, krzem, mangan, arsen nazywa się, odpowiednio, brązami aluminiowymi, berylowymi, krzemowymi, manganowymi, arsenowymi. Stop miedzi z niklem nosi nazwę miedzionikiel[1][6].
Na duże znaczenie brązu w rozwoju cywilizacji wskazuje fakt wyodrębnienia w prehistorii epoki brązu. Najstarsze wyroby z brązu, wytwarzano na Bliskim Wschodzie już w V tysiącleciu p.n.e., na Bałkanach między IV a początkiem drugiej połowy III tysiąclecia. Stężenie dodatku stopowego dobierano tak, aby miedź uzyskała odpowiednio wysoką twardość bez utraty plastyczności, ułatwiającej obróbkę. Zależnie od rodzaju produkowanych wyrobów stosowano stopy zawierające do 10–14% cyny.
Współczesna wiedza nt. struktury metali oraz równowag i kinetyki przemian fazowych w stopach pozwala przewidywać wpływ stężenia dodatków oraz sposobu obróbki cieplnej (termicznej) na mechaniczne właściwości stopu.
W układzie współrzędnych temperatura–skład przedstawia się wykresy fazowe, wskazujące granice termodynamicznej trwałości określonych faz (kryształów o określonej budowie). Pomiędzy obszarami występowania pojedynczych faz mieszczą się „obszary współistnienia” – pola wykresu, w których stop zawiera dwie fazy, znajdujące się w równowadze termodynamicznej. Stopy zawierają fazy zgodne z wykresami wtedy, gdy szybkość ogrzewania lub chłodzenia jest bardzo mała. W tych warunkach mogą zakończyć się powolne procesy dyfuzji w fazie stałej, np. proces dyfuzji jonów metalu rozpuszczonego w kryształach obcej sieci do ich powierzchni i tworzenie tam nowych kryształów, o innej strukturze (kryształy fazy współistniejącej).
Stopy otrzymywane w wyniku szybkiego chłodzenia mogą zawierać kryształy roztworów przesyconych (skład opisany punktami w obszarze współistnienia), o silnie zdefektowanej sieci krystalicznej, charakteryzujące się mniejszą plastycznością, a większą twardością i kruchością.
Wykresy fazowe stopów miedzi z niklem, cyną i cynkiem wyjaśniają zależność właściwości metalu od zawartości dodatku stopowego[1][7][8].
-
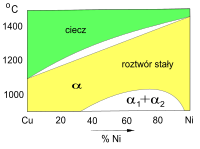
Wykres fazowy Cu–Ni (fragment)
Roztwór stały ciągły (faza α) -
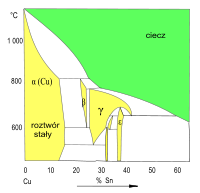
Wykres fazowy Cu–Sn (fragment)
Roztwory stałe w sieci Cu (faza α) i fazach międzymetalicznych (β, γ, δ...) -
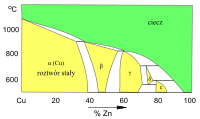
Wykres fazowy Cu–Zn (fragment)
Roztwory stałe w sieci Cu (faza α) i fazach międzymetalicznych (β, γ, δ...)
W układzie Cu–Ni (miedzionikiel) składniki tworzą roztwór ciągły – rozpuszczają się wzajemnie w fazie stałej w całym zakresie stężeń. Jest to możliwe dzięki temu, że spełniają kryteria Hume’a i Rothery’ego: mają ten sam typ sieci krystalicznej (sieć regularna zwarta, regularna ściennie centrowana) oraz podobne wymiary komórki elementarnej, średnice jonów i elektroujemność. Kryształy roztworu stałego (faza α), powstające w cieczy o dowolnym składzie, zawierają początkowo więcej niklu niż ciecz. Jeżeli proces jest powolny stopniowo wzbogacają się w jony Cu, co powoduje, że wyrównuje się skład wszystkich ziaren[9]. W przypadku szybkiego chłodzenia cieczy otrzymywany stop jest mieszaniną ziaren roztworu stałego o różnej zawartości obu składników. Jest to przyczyną mniejszej odporności na korozję elektrochemiczną (powstawanie mikroogniw korozyjnych).
W miedzioniklach zawierających więcej niż 30% Ni w temperaturze niższej od 1000 °C zachodzi dodatkowa przemiana fazowa. W tych warunkach termodynamicznie korzystne jest istnienie dwóch struktur α, różniących się sposobem uporządkowania jonów Cu i Ni w sieci krystalicznej (przemiana analogiczna do powstawanie dwóch niemieszających się cieczy).
Z fazowych wykresów układów Cu–Sn i Cu–Zn wynika możliwość tworzenia większej liczby różnych faz stałych. W tych układach mogą powstawać kryształy faz międzymetalicznych („związków międzymetalicznych”). Roztwory stałe, w których osnową jest sieć fazy międzymetalicznej, są oznaczane symbolami β, γ, δ, ε. Zakres zmienności składu tych roztworów stałych (szerokość obszaru termodynamicznej trwałości na wykresie fazowym) jest mniejszy od odpowiedniego zakresu zmienności składu krystalitów roztworu stałego dodatku stopowego (Sn, Zn) w sieci krystalicznej miedzi (faza α).
Stal i żeliwo
[edytuj | edytuj kod]





Po epoce brązu nastąpiła epoka żelaza, materiału wytwarzanego z surowców bardziej dostępnych (początkowo – ruda darniowa i meteoryty żelazne) i bardziej wytrzymałego mechanicznie – lepiej nadającego się np. na zbroje, miecze, narzędzia. Wyroby z kutego żelaza wytwarzano już w XV i XIV wieku p.n.e. na terenach zamieszkałych przez Hetytów. Technologia wędrowała stamtąd do Palestyny, Egiptu, Mezopotamii. W XII w p.n.e. była znana w Grecji, a w XI-X w. p.n.e. – w Italii.
Opanowanie technik wytwarzania stopów z innymi metalami oraz metod obróbki cieplnej i cieplno chemicznej i odegrało istotną rolę w okresie rewolucji neolitycznej i rewolucji przemysłowej. Współcześnie stosowane są stopy o znormalizowanym składzie, otrzymywane z wykorzystaniem takich technik obróbki cieplno-chemicznej stopów żelaza, jak kaloryzowanie, azotowanie, naborowywanie, chromowanie, nawęglanie, siarkowanie lub węgloazotowanie (cyjanowanie).
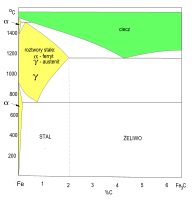
Teoretyczną podstawą procesów wytwarzania żeliwa i stali węglowych o pożądanych właściwościach jest wiedza na temat przemian fazowych, zachodzących w stopach żelaza z węglem[1]. Wykres fazowy wskazuje zakres termodynamicznej trwałości roztworów stałych węgla w sieci krystalicznej dwóch odmian alotropowych żelaza (α-Fe i γ-Fe). W sieciach krystalicznych obu odmian występują luki mniejsze od promienia atomu węgla, ale powstają roztwory stałe międzywęzłowe:
- austenit – roztwór stały węgla w żelazie γ-Fe (sieć regularna ściennie centrowana, rsc); maksymalna rozpuszczalność węgla – do ok. 2% C
- ferryt – roztwór stały węgla w żelazie α-Fe (sieć regularna przestrzennie centrowana, rpc); maksymalna rozpuszczalność węgla – do ok. 0,02% C (w temperaturze pokojowej – do 0,008%)
W sieci krystalicznej żelaza α-Fe występują mniejsze luki oktaedryczne (oba obszary termodynamicznej trwałości roztworów węgla w α-Fe są – wysoko- i niskotemperaturowy temperaturowy – są bardzo wąskie). Mechaniczne właściwości stali węglowej są zależne przede wszystkim od stanu ziaren austenitu (międzywęzłowe roztwory stałe węgla w γ-Fe). Od stężenia węgla i sposobu obróbki cieplnej zależy wielkość tych ziaren i liczba defektów sieci.
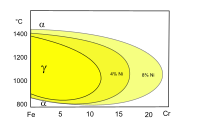
Zakres trwałości obu odmian alotropowych Fe oraz rozpuszczalność węgla w ich sieci krystalicznej są zależne od zawartości innych dodatków stopowych, np. zawartości chromu. Chrom jest składnikiem stali kwasoodpornych. Tworzy z α-Fe roztwory stałe ciągłe, a stężenie chromu w sieci γ-Fe może przekraczać 10%. Rozpuszczalność chromu w γ-Fe zwiększa dodatek niklu.
-
Wykres fazowy Fe–Fe3C
-
Wykres fazowy Fe–Cr
-
Wykres fazowy Fe–Cr–Ni (fragment)
Roztwory stałe w mineralogii
[edytuj | edytuj kod]
Występowanie roztworów stałych jest zjawiskiem powszechnym wśród minerałów. Przykładem są np. oliwiny, plagioklazy, turmaliny i granaty. Roztwory stałe powstają gdy między dwoma minerałami dochodzi do wzajemnej zamiany kationu w dowolnej proporcji, tak jak ma to miejsce w przypadku magnezu i żelaza w forsterycie i fajalicie.
Niekiedy substancje, które tworzą roztwory stałe, w wysokiej temperaturze, tracą tę zdolność, gdy temperatura obniża się. Jeśli spadek temperatury jest powolny, następuje rozpad roztworu stałego: substancja, która znajduje się w roztworze w mniejszej ilości, krystalizuje tworząc inkluzje (wrostki), wewnątrz kryształu substancji przeważającej. Zjawisko to jest znane pod nazwą „odmieszania się” roztworu stałego i bywa wykorzystywane jako dowód na to w jakiej temperaturze doszło do rozpadu minerału w trakcie dawnych procesów geologicznych. Przykładem tego zjawiska są skały magmowe plutoniczne powstałe w procesie zastygania magmy. W miarę ochładzania się skaleń potasowy (ortoklaz) i skaleń sodowy (albit), które tworzyły jeden roztwór stały, rozdzielają się. Rezultatem tego procesu jest powstawanie przerostków tych skaleni, tzw. pertytów (ortoklaz z inkluzjami skalenia sodowego). Gdy ochłodzenie jest gwałtowne (w wypadku lawy wulkanicznej) roztwór stały pozostaje przez długi czas w stanie metatrwałym.
Zobacz też
[edytuj | edytuj kod]- heterodyfuzja
- idiomorfizm
- izomorfizm (krystalografia)
- mechanizm wakansowy dyfuzji
- parageneza
- paramorfoza
- polimorfizm (krystalografia)
- pseudomorfoza
- właściwości fizyczne i chemiczne minerałów
Przypisy
[edytuj | edytuj kod]- ↑ a b c d e f g h i j k l m n Encyklopedia techniki. T. Metalurgia: Metalurgia. Katowice: Wydawnictwo „Śląsk”, 1978, s. 150, 201, 288, 516-517, 625–626 i inne. (pol.).
- ↑ a b Leksykon naukowo-techniczny z suplementem. T. P-Ż. Warszawa: WNT, 1989, s. 835, 930, 1104. ISBN 83-204-0969-1.
- ↑ Walenty Jasiński. Budowa stopów; rodzaje faz. „Materiały dydaktyczne Politechniki Szczecińskiej”, s. 35–55. Politechnika Szczecińska. [dostęp 2015-07-12]. [zarchiwizowane z adresu 2011-11-25].
- ↑ Leszek A. Dobrzański: Metaloznawstwo z podstawami nauki o materiałach. Wyd. 3. Warszawa: Wydawnictwa Naukowo-Techniczne, 1996, s. 115. ISBN 83-204-2086-5. (pol.).
- ↑ Leksykon naukowo-techniczny z suplementem. T. A-O. Warszawa: WNT, 1989, s. 485, 573. ISBN 83-204-0969-1.
- ↑ ZMiO, PS. Podstawy nauki o materiałach. Struktury stopów miedzi. „Materiały dydaktyczne”. Zakład metaloznawstwa i odlewnictwa PS.
- ↑ Miedź i jej stopy. www.pg.gda.pl. (pol.).
- ↑ Walenty Jasiński. Budowa stopów; stopy miedzi. „Materiały dydaktyczne Politechniki Szczecińskiej”, s. 148–156. Politechnika Szczecińska. [dostęp 2015-07-12]. [zarchiwizowane z adresu 2011-08-12].
- ↑ Copper – Nickel Example. www.sv.vt.edu. [dostęp 2011-03-29]. [zarchiwizowane z tego adresu (2011-05-14)]. (ang.).
Bibliografia
[edytuj | edytuj kod]- St. Rudnik: Metaloznawstwo. Warszawa: PWN, 1996. (pol.).
- St. Prowans: Materiałoznawstwo. Warszawa: PWN, 1997. (pol.).
- K. Przybyłowicz: Metaloznawstwo. Warszawa: WNT, 1996. (pol.).
- K. Wesołowski: Metaloznawstwo i obróbka cieplna. Warszawa: WNT, 1981. (pol.).