Organocatálise

Em química orgânica, o termo organocatálise (um portmanteau dos termos "orgânico" e "catalisador") refere-se a uma forma de catálise, pelo que a taxa de um reação química é aumentada por um catalisador orgânico referido como um "organocatalisador" consistindo de carbono, hidrogênio, enxofre e outros elementos não metálicos encontrados em compostos orgânicos.[3][4][5][6][7][8] Devido à sua semelhança na composição e descrição, eles são muitas vezes confundidos como um misnômero para enzimas devido a seus efeitos comparáveis sobre taxas de reação e formas de catálise envolvidas.
Organocatalisadores que exibem funcionalidade amina secundária podem ser descritos como realizando tanto catálise de enamina (por formação de quantidades catalíticas de um nucleófilo enamina ativo), como catálise de imíniums (por formação de quantidades catalíticas de um imínium eletrófilo ativado). Este mecanismo é típico para organocatálise covalente. Ligação covalente de substrato normalmente requer alta carga de catalisador (para catálise de prolina, tipicamente 20-30 mol%).
Interações não covalentes tal como ligações de hidrogénio facilitam baixas cargas de catalisador (até 0,001 mol%).
Organocatálise oferece diversas vantagens. Não há necessidade de catálise baseada em metal consequentemente fazendo uma contribuição à química verde. Neste contexto, ácidos orgânicos simples tem sido usados como catalisadores para a modificação de celulose em água em escala multi-tonelada.[9] Quando o organocatalisador é quiral abrem-se possibilidades para catálise assimétrica, por exemplo o uso de prolina em reações aldólicas é um exemplo de quiralidade e química verde.[10]
Introdução
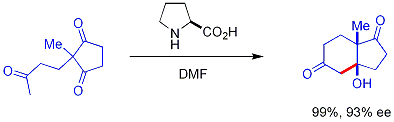
[editar | editar código-fonte]Organocatalisadores aquirais regulares são baseados em compostos contendo nitrogênio, como piperidina usada na condensação de Knoevenagel.[11] DMAP usada nas esterificações e DABCO usado na reação de Baylis-Hillman. Sais de tiazólium são empregados na reação de Stetter. Estes catalisadores e reações tem uma longa história mas o interesse atual em organocatálise é focado em catálise assimétrica com catálise quiral, chamada organocatálise assimétrica ou organocatálise enantiosseletiva. Uma reação pioneira desenvolvida nos anos 1970 é chamada reação dе Hajos–Parrish–Eder–Sauer–Wiechert. Entre 1968 e 1997, houve apenas alguns relatos sobre o uso de pequenas moléculas orgânicas como catalisadores para reações assimétricas (a reação de Hajos–Parrish provavelmente sendo a mais famosa), mas esses estudos químicos foram vistos mais como reações químicas únicas do que as partes integrantes de um campo maior e interconectado.[12]
Nesta reação, prolina quiral ocorrendo naturalmente é o catalisador quiral em uma reação aldólica. O material de partida é uma tricetona aquiral e requer apenas 3% de prolina para obter o produto de reação, um cetol em 93% excesso enantiomérico. Este é o primeiro exemplo de uma reação aldólica assimétrica catalisada por aminoácido.[13][14]
A síntese assimétrica da cetona de Wieland-Miescher (1985) é também baseada em prolina e outra aplicação precoce foi uma das transformações na síntese total de eritromicina por Robert B. Woodward (1981).[15] Um artigo de revisão enfoca os exemplos recentes selecionados de síntese total de produtos naturais e farmacêuticos usando reações organocatalíticas.[16]
Muitos organocatalisadores quirais são uma adaptação de ligandos quirais (a qual conjuntamente com um centro metálico também catalisam reações assimétricas) e ambos os conceitos se sobrepõem até certo ponto.
Referências
- ↑ Justus von Liebig, Justus (1860). «Ueber die Bildung des Oxamids aus Cyan». Annalen der Chemie und Pharmacie. 113 (2): 246–247. doi:10.1002/jlac.18601130213
- ↑ W. Langenbeck (1929). «Über organische Katalysatoren. III. Die Bildung von Oxamid aus Dicyan bei Gegenwart von Aldehyden». Liebigs Ann. 469. 16 páginas. doi:10.1002/jlac.19294690103
- ↑ Berkessel, A., Groeger, H. (2005). Asymmetric Organocatalysis. Weinheim: Wiley-VCH. ISBN 3-527-30517-3
- ↑ Special Issue: List, Benjamin (2007). «Organocatalysis». Chem. Rev. 107 (12): 5413–5883. doi:10.1021/cr078412e
- ↑ Peter I. Dalko; Lionel Moisan (2004). «In the Golden Age of Organocatalysis». Angew. Chem. Int. Ed. 43 (39): 5138–5175. doi:10.1002/anie.200400650
- ↑ Matthew J. Gaunt; Carin C.C. Johansson; Andy McNally; Ngoc T. Vo (2007). «Enantioselective organocatalysis». Drug Discovery Today. 12 (1/2): 8–27. PMID 17198969. doi:10.1016/j.drudis.2006.11.004
- ↑ Dieter Enders; Christoph Grondal; Matthias R. M. Hüttl (2007). «Asymmetric Organocatalytic Domino Reactions». Angew. Chem. Int. Ed. 46 (10): 1570–1581. doi:10.1002/anie.200603129
- ↑ Peter I. Dalko; Lionel Moisan (2001). «Enantioselective Organocatalysis». Angew. Chem. Int. Ed. 40 (20): 3726–3748. doi:10.1002/1521-3773(20011015)40:20<3726::AID-ANIE3726>3.0.CO;2-D
- ↑ International Patent WO 2006068611 A1 20060629 " Direct Homogeneous and Heterogeneous Organic Acid and Amino Acid-Catalyzed Modification of Amines and Alcohols" Inventors: Armando Córdova, Stockholm, Sweden; Jonas Hafrén, Stockholm, Sweden.
- ↑ Example 4 in U.S. Patent 3,975,440 August 17, 1976, Filed Dec. 9, 1970 Zoltan G. Hajos and David R. Parrish.
- ↑ List, B. (2010). «Emil Knoevenagel and the Roots of Aminocatalysis». Angewandte Chemie International Edition in English. 49 (10): 1730–1734. PMID 20175175. doi:10.1002/anie.200906900
- ↑ "The advent and development of organocatalysis" David C. MacMillan, NATUREVol 455|18 September 2008|doi:10.1038/nature07367
- ↑ Z. G. Hajos, D. R. Parrish, German Patent DE 2102623 1971
- ↑ Zoltan G. Hajos; David R. Parrish (1974). «Asymmetric synthesis of bicyclic intermediates of natural product chemistry». J. Org. Chem. 39 (12): 1615–1621. doi:10.1021/jo00925a003
- ↑ R. B. Woodward; E. Logusch; K. P. Nambiar; K. Sakan; D. E. Ward; B. W. Au-Yeung; P. Balaram; L. J. Browne; et al. (1981). «Asymmetric total synthesis of erythromcin. 1. Synthesis of an erythronolide A secoacid derivative via asymmetric induction». J. Am. Chem. Soc. 103 11 ed. pp. 3210–3213. doi:10.1021/ja00401a049
- ↑ B. -F. Sun (2015). «Total synthesis of natural and pharmaceutical products powered by organocatalytic reactions». Tetrahedron Lett. 56 17 ed. pp. 2133–2140. doi:10.1016/j.tetlet.2015.03.046