Kyanid
| Kyanid | |
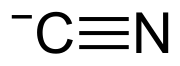 | |
 | |
| Všeobecné vlastnosti | |
| Sumárny vzorec | CN- |
| Fyzikálne vlastnosti | |
| Molárna hmotnosť | 26,018 g/mol |
| Ďalšie informácie | |
| Číslo CAS | 57-12-5 |
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |
Kyanid je anorganický anión, ktorého vzorec je CN−. Vzniká napríklad deprotonáciou kyanovodíka, od ktorého je formálne odvodený. S rôznymi protiiónmi tvorí soli, ktoré sa všeobecne označujú ako kyanidy. Analogické organické zlúčeniny, obsahujúce funkčnú skupinu -CN, sa nazývajú nitrily.
Rozpustné kyanidy sú prudké jedy, na vzduchu vplyvom vlhkosti a oxidu uhličitého a aj v kyslom prostredí uvoľňujú rovnako prudko jedovatý kyanovodík. Ich jedovatosť spočíva v bránení prenosu kyslíka z krvi do tkaniva.
Toxicita
[upraviť | upraviť zdroj]Hlavným účinkom kyanidu je inhibícia oxidatívnej fosforylácie, čo je proces, pri ktorom sa využíva kyslík v bunkovom dýchaní na tvorbu ATP. Kyanid sa reverzibilne viaže na železité ióny prítomné v cytochróm c oxidáze v mitochondriách, čím blokuje bunkové dýchanie, konkrétne premenu kyslíku na vodu.[1] Na základe toho dochádza k bunkovej hypoxii a spotrebovaniu ATP, čo vedie k metabolickej acidóze.[1]
Soli
[upraviť | upraviť zdroj]Kyanidový anión tvorí mnohé anorganické soli s rôznymi protiiónmi, napríklad:
- kyanid amónny
- kyanid sodný
- kyanid draselný (cyankáli)
- kyanid vápenatý
- hexakyanoželeznatan železitý (pruská modrá)
Referencie
[upraviť | upraviť zdroj]- ↑ a b GRAHAM, Jeremy; TRAYLOR, Jeremy. Cyanide Toxicity. Treasure Island (FL) : StatPearls Publishing, 2022. PMID: 29939573. Dostupné online.
Zdroj
[upraviť | upraviť zdroj]Tento článok je čiastočný alebo úplný preklad článku Kyanidy na českej Wikipédii.
