Naftalen
| |||
| |||
| |||
| Imena | |||
|---|---|---|---|
| IUPAC ime
biciklo[4.4.0]deka-1,3,5,7,9-penten
| |||
| Sistematično ime
biciclo[4.4.0]deka-1,3,5,7,9-penten, biciklo[4.4.0]deca-2,4,6,8,10-penten | |||
| Druga imena
naftalin
| |||
| Identifikatorji | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.001.863 | ||
| EC število |
| ||
| KEGG | |||
PubChem CID
|
|||
| RTECS število |
| ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Lastnosti | |||
| C10H8 | |||
| Molska masa | 128,17 g·mol−1 | ||
| Videz | beli luskasti kristali | ||
| Vonj | močan vonj po premogovem katranu | ||
| Gostota | 1,145 g/cm3 (15,5 °C)[1] 1,0253 g/cm3 (20 °C)[2] 0,9625 g/cm3 (100 °C)[1] | ||
| Tališče | 78,2 °C (172,8 °F; 351,3 K) | ||
| Vrelišče | 217,97 °C (424,35 °F; 491,12 K) | ||
| 19 mg/L (10 °C) 31,6 mg/L (25 °C) 43,9 mg/L (34,5 °C) 80,9 mg/L (50 °C)[2] 238,1 mg/L (73,4 °C)[3] | |||
| Topnost | topen v alkoholih, tekočem amonijaku, karboksilnih kislinah, benzenu, žveplovem dioksidu,[3] ogljikovem tetrakloridu, ogljikovem disulidu, toluenu in anilinu[4] | ||
| Topnost (etanol) | 5 g/100 g (0 °C) 11,3 g/100 g (25 °C) 19,5 g/100 g (40 °C) 179 g/100 g (70 °C)[4] | ||
| Topnost (ocetna kislina) | 6,8 g/100 g (6,75 °C) 13,1 g/100 g (21,5 °C) 31,1 g/100 g (42,5 °C) 111 g/100 g (60 °C)[4] | ||
| Topnost (kloroform) | 19,5 g/100 g (0 °C) 35,5 g/100 g (25 °C) 49,5 g/100 g (40 °C) 87,2 g/100 g (70 °C)[4] | ||
| Topnost (heksan) | 5,5 g/100 g (0 °C) 17,5 g/100 g (25 °C) 30,8 g/100 g (40 °C) 78,8 g/100 g (70 °C)[4] | ||
| Topnost (maslena kislina) | 13,6 g/100 g (6,75 °C) 22,1 g/100 g (21,5 °C) 131,6 g/100 g (60 °C)[4] | ||
| log P | 3,34[2] | ||
| Parni tlak | 8,64 Pa (20 °C) 23,6 Pa (30 °C) 0,93 kPa (80 °C)[3] 2,5 kPa (100 °C)[5] | ||
| kH | 0,42438 L·atm/mol[2] | ||
| Toplotna prevodnost | 98 kPa: 0,1219 W/m·K (372,22 K) 0,1174 W/m·K (400,22 K) 0,1152 W/m·K (418,37 K) 0,1052 W/m·K (479,72 K)[6] | ||
| Lomni količnik (nD) | 1,5898[2] | ||
| Viskoznost | 0,964 cP (80 °C) 0,761 cP (100 °C) 0,217 cP (150 °C)[7] | ||
| Struktura | |||
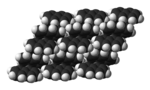
| Kristalna struktura | monoklinska[8] | ||
| Prostorska skupina | P21/b[8] | ||
| C5 2h[8] | |||
a = 8,235 , b = 6,003 , c = 8,658 [8] α = 90°, β = 122,92°, γ = 90°
| |||
| Termokemija | |||
| Specifična toplota, C | 165,72 J/mol·K[2] | ||
| Standardna molarna entropija S |
167,39 J/mol·K[2][5] | ||
Std tvorbena
entalpija (ΔfH⦵298) |
78,53 kJ/mol[2] | ||
Gibbsova prosta energija (ΔfG˚)
|
201,585 kJ/mol[2] | ||
Std sežigna
entalpija (ΔcH⦵298) |
5156,3 kJ/mol[2] | ||
| Nevarnosti | |||
| Glavne nevarnosti | vnetljiv, morda rakotvoren, z zrakom tvori eksplozivne zmesi | ||
| GHS piktogrami |     [9] [9]
| ||
| Opozorilna beseda | Pozor | ||
| H228, H302, H351, H410[9] | |||
| P210, P273, P281, P501[9] | |||
| NFPA 704 (diamant ognja) | |||
| Plamenišče | 80 °C (176 °F; 353 K) | ||
| 525 °C (977 °F; 798 K) | |||
| Meje eksplozivnosti |
5,9 %[9] | ||
| 10 ppm[2] (TWA), 15 ppm[2] (STEL) | |||
| Smrtni odmerek ali koncentracija (LD, LC): | |||
LD50 (srednji odmerek)
|
2000 mg/kg (podgana, oralno) | ||
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |||
| Sklici infopolja | |||
Naftalen je najenostavnejši policiklični aromatski ogljikovodik z kemijsko formulo C10H8, bolj znan kot naftalin. Pri standardnih pogojih je bela kristalinilčna snov z značilnim vonjem, zaznavnim že pri koncentraciji 0,08 ppm.[10] Pri sobni temperaturi sublimira in odvrača žuželke, zato so ga včasih uporabljali v kroglicah proti moljem. Danes se uporablja predvsem kot surovina za sintezo barvil in zdravil, v gospodinjstvih pa zaradi negativnih učinkov na zdravje ne več. V večjih koncentracijah, predvsem ob zaužitju, povzroča poškodbe in odmiranje rdečih krvničk, posredno pa tudi rakave spremembe.
Zgodovina
[uredi | uredi kodo]Na začetku 1820. let sta dva kemika v ločenih poročilih opisala belo trdno snov z ostrim vonjem, ki sta jo pridobila z destilacijo premogovega katrana. Odkritji je leta 1821 povzel John Kidd in opisal tudi številne lastnosti nove snovi in način pridobivanja. Zanjo je predlagal ime naftalin, ker je bila pridobljena iz vrste nafte. Pojem nafte je bil takrat zelo širok in je zajemal vse hlapne in vnetljive tekoče ogljikovodike, vključno s premogovim katranom.[11]
Kemijsko formulo naftalena je določil Michael Faraday leta 1826. Strukturo z dvema kondenziranima benzenovima obročema, ki jo je leta 1866 predpostavil Emil Erlenmayer, je tri leta kasneje potrdil Carl Gräbe.
Zgradba in reaktivnost
[uredi | uredi kodo]Na molekulo naftalena lahko gledamo kot na par zlitih benzenovih obročev. Zlivanje obročev v organski kemiji pomeni, da si obroča delita najmanj dva ogljikova atoma. Naftalen je zato opredeljen kot benzenoidni policiklični aromatski ogljikovodik.
Molekula vsebuje dva niza enakovrednih vodikovih atomov: α-H atome na položajih 1, 4, 5 in 8 in β–H atome na položajih 2, 3, 6 in 7.
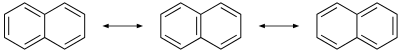
V nasprotju z benzenom vezi med ogljikovimi atomi v naftalenu niso enako dolge. Vezi C1–C2, C3–C4, C5–C6 in C7–C8 so dolge približno 1,36 Å (136 pm), medtem ko so druge dolge približno 1,42 Å (142 pm). Razlika, ki je bila ugotovljena z rentgensko difrakcijo, je skladna z valenčno teorijo kemijske vezi, ki pri naftalenu vključuje tri resonančne strukture, prikazane na spodnji sliki. Iz prikaza je razvidno, da se dvojne vezi med atomi C1–C2, C3–C4, C5–C6 in C7–C8 pojavljajo v dveh od treh zgradb, medtem ko se drugod pojavijo samo v eni.
Naftalen je, podobno kot benzen, podvržen elektrofilni aromatski substituciji. V mnogih tovrstnih substitucijah reagira pod milejšimi pogojih kot benzen. Primer: benzen in naftalen reagirata s klorom v prisotnosti katalizatorja železovegaali aluminijevega klorida, naftalen pa reagira s klorom tudi brez katalizatorja in tvori 1-kloronaftalen. Oba se lahko tudi alkilirata s Friedel–Craftsovo reakcijo, naftalen pa se lahko alkilira tudi z alkeni in alkoholi z žveplovo ali fosforno kislino kislino kot katalizatorjem.
Substituirani derivati
[uredi | uredi kodo]Monosubstituirani derivati naftalena imajo dva možna izomera, ki ustrezata substituciji α ali β vodikovega atoma. Elektrofili običajno napadejo α položaj. Prednost α substitucije pred β substitucijo se lahko pojasni z resonančnimi strukturami vmesnega produkta: za vmesni produkt za α substitucijo se lahko nariše sedem resonančnih struktur, od katerih so štiri aromatske. Za vmesni produkt za β substitucijo se lahko nariše samo šest resonančnih struktur, od katerih sta samo dve aromatski. Sulfonacija daje kljub temu zmes 1- in 2-naftalenslulfonske kisline. Razmerje men njima je odvisno od reakcijskih pogojev: pri 25 °C prevladuje 1-izomer, pri 160 °C pa 2-izomer.
Naftalen se pri visokem tlaku in prisotnosti kovinskih katalizatorjev lahko hidrogenira, pri čemer nastane 1,2,3,4-tetrahirdonaftalen ali tetralin (C10H12). Z nadaljnjim hidrogeniranjem nastane dekahidronaftalen ali dekalin (C10H18). Z oksidacijo s kromatom ali permanganatom ali s katalitsko oksidacijo s kisikom v prisotnosti vanadijevega katalizatorja nastane ftalna kislina.
Proizvodnja
[uredi | uredi kodo]Večino naftalena se proizvede iz premogovega katrana, ki nastane po suhi destilaciji premoga. V letih 1960-2000 se je velik del naftalena proizvedel tudi v rafinerijah iz težkih frakcij nafte.
Naftalen je najpogostejša komponenta premogovega katrana. Četudi je sestava katrana zelo odvisna od vrste premoga, je v tipičnem katranu okrog 10 % naftalena. V njegovem destilatu je poleg številnih drugih aromatskih spojin okrog 50 % naftalena. Iz destilata se z izpiranjem z natrijevim hidroksidom najprej odstranijo kisle komponente, med katerimi prevladujejo razni fenoli, in nato z izpiranjem z žveplovo kislino še alkalne komponente. Iz ostanka se s frakcionirano destilacijo izloči naftalen. Surov naftalen vsebuje približno 95 % naftalena. Glave nečistoče so žveplove aromatske spojine benzotiofen (< 2%), indan (0.2%), inden (< 2%) in metilnaftalen (< 2%). Naftni naftalen je običajno bolj čist.
Če je potrebno, se surovi naftalen dodatno rafinira s prekristalizacijo iz različnih topil. Proizvod vsebuje 99% naftalena s tališčem 80 °C. Letna proizvodnja naftalena je približno 1,3 milijona ton.[12]
Največji proizvajalci naftalena v Severni Ameriki so Koppers Inc., Ruetgers Canada Inc. in Recochem Inc. (iz premogovega katrana) in Advanced Aromatics, L.P. (iz nafte), v Zahodni Evropi Koppers, Ruetgers in Deza, v Vzhodni Evropi pa velike koksarne, predvsem Severstal, Evraz, Mechel in MMK v Rusiji. Velika proizvajalca naftalena in fenola sta INKOR in Jenakievski v Ukrajini in ArcelorMittal Temirtau v Kazahstanu.
Drugi viri in nahajališča
[uredi | uredi kodo]Naftalen v sledovih proizvajajo tudi magnolije, nekatere vrste jelenov in formoški podzemni termiti, slednji verjetno zaradi obrambe proti mravljam, strupenim glivam in glistam.[13] Nekaj naftalena prizvaja poleg drugih hlapnih organskih spojin tudi gliva Muscodor albus, medtem ko gliva Muscodor vitigenus proizvaja skoraj izključno naftalen.[14]
Naftalen so odkrili tudi v meteoritih.
Naftalen v medzvezdnem prostoru
[uredi | uredi kodo]Naftalen so pogojno odkrili v medzvezdnem prostoru v smeri zvezde Cernis 52 in v ozvezdju Perzeja.[15][16] Pogojno zato, ker tega ni potrdil še noben drug neodvisen vir.
Več kot 20% ogljikovodikov v vesolju bi lahko bilo povezano s poliaromatskimi ogljikovodiki, vključno z naftalenom.[17]
Protonirani kationi naftalena (C
10H+
9), ki se od nevtralnih razlikujejo po dodatnem vodikovem atomu (protonu), so vir dela spektra neidentificiranih emisij infrardeče svetlobe (UIRs). Spekter protoniranega naftalena so opazili in objavili astronomi.[18]
Uporaba
[uredi | uredi kodo]Surovina
[uredi | uredi kodo]Naftalen se uporablja predvsem kot surovina za druge proizvode, največ za ftalanhidrid, čeprav se večina ftalanhidrida proizvede iz o-ksilena. Med druge proizvode spadajo alkil naftalen sulfonatna površinsko aktivna sredstva (tenzidi) in insekticid 1-naftil-N-metilkarbamat (karbaril). Naftaleni, substituirani s kombinacijo funkcionalnih skupin, ki so izraziti donorji elektronov, kakršni so alkoholi in amini, in skupin, ki so izraziti prejemniki elektronov, predvsem sulfonskih kislin, so izhodne surovine za pripravo številnih sintetičnih barvil. Hidrogenirana naftalena tetralin in dekalin sta lahko hlapni topili. Naftalen se uporablja tudi za sintezo 2-naftola, ki je osnova za sintezo različnih barvil, pigmentov, kemikalij za obdelavo gume in drugih kemikalij in farmacevtskih proizvodov.[12]
Naftalen sulfonske kisline so surovine za proizvodnjo polimernih mehčal, ki se uporabljajo v proizvodnji betona, mavčnih plošč, naravne in sintetične gume, strojil za usnje, kot dispergirna sredstva za pesticide, barvila in plošče svinčevih akumualatorjev.
Naftalensulfonatni polimeri se proizvajajo sulfonacijo naftalena z žveplovo kislino
- H
2SO
4 + C
10H
8 → C
10H
7-SO
3H + H
2O,
kateri sledita polimerizacija s formaldehidom
- C
10H
7-SO
3H + CH
2=O → SO
3H-C
10H
7-(-CH
2-C
10H
7-SO
3H)
n + H
2SO
4
in nevtralizacija z natrijevim hidroksidom)
- C
10H
7-SO
3H-(C
10H
7-SO
3H)
n + NaOH → C
10H
7-SO
3Na-(C
10H
7-SO
3Na)
n + H
2O + Na
2SO
4
Topilo v kemijskih reakcijah
[uredi | uredi kodo]Staljen naftalen je odlično topilo za slabo topne aromatske spojine. V mnogo primerih je bolj učinkovit kot druga, bolj hlapna topila, kot so diklorobenzen, benzonitril, nitrobenzen in duren (1,2,4,5-tetrametilbenzen). Reakcija C60 z ekvimolarno količino antracena v refluktirajočem naftalenu daje 1:1 Diels-Alderjev adukt s 67% izkoristkom:[19]
Postopek, ki so ga razvili za aromatizacijo porfirinov, vključuje segrevanje z 2,3-dikloro-5,6-diciano-1,4-benzokinonom (DDQ) v talini naftalena. Naftalen je edini, ki ne zagotavlja samo dovoljnje topnosti reaktantov, ampak ima vpliv tudi na selektivnost procesa:[20]
Površinsko aktivno sredstvo
[uredi | uredi kodo]Alkil naftalen sulfonati (ANS) se v mnogih industrijskih procesih uporabljajo kot omakala, ki učinkovito dispergirajo koloidne sisteme v nevodnih medijih. Uporabljajo se predvsem v kemični industriji, v kmetijstvu kot omakala za praškaste in granulirane snovi in v tekstilni industriji kot protipenilci pri beljenju in barvanju tekstilij.
Naftalen se je nekoč v gospodinjstvih uporabljal kot sredstvo za zatiranje moljev. Sedaj so ga nadomestili drugi fumiganti, na primer 1,4-diklorobenzen. Kroglice naftalena so v zaprtem prostoru izparele do te mere, da so postale pare strupene za veliko vrst odraslih moljev in njihovih ličink, ki so napadale tekstilije. Naftalen se uporablja tudi v zemlji kot pesticid, na podstrešjih za odganjanje živali in žuželk in v muzejih v predalih in omarah kot sredstvo za odganjanje mrčesa.
Drugo
[uredi | uredi kodo]V pirotehniki se uporablja za posebne efekte, na primer za tvorjenje črnega dima v simuliranih eksplozijah. V preteklosti so ga uporabljali tudi peroralno za zatiranje parazitskih glist v živini. Naftalen in njegovi alkini homologi so glavna sestavina kreozota, ki se uporablja na primer za zaščito lesa. V kemijskem inženirstvu se uporablja za preučevanje prenosa toplote s sublimacijo.
Vplivi na zdravje
[uredi | uredi kodo]Izpostavljenost veliki količini naftalena lahko poškoduje ali uniči rdeče krvničke. Bolezen, ki je znana kot hemolitična anemija, se je pojavljala predvsem pri otrocih po zaužitju kroglic naftalena ali dezodorantov, ki so vsebovali naftalen. Simptomi bolezni so utrujenost, pomanjkanje apetita, nemir in bleda koža. Izpostavljenost veliki količini naftalena lahko povzroči zmedenost, slabost, bruhanje, drisko, kri v urinu in zlatenico (rumeno obarvano kožo).[21] Več kot 400 milijonov ljudi ima prirojeno motnjo, imenovano pomanjkanje encima glukoza-6-fosfat dehidrogenaze. Izpostavljenost naftalenu je zanje še bolj škodljivo in lahko povzroči hemolitično anemijo že pri nižjih odmerkih.[22]
V Združenih državah so v okviru Nacionalnega toksikološkega programa izpostavili podgane in miši obeh spolov delovanju hlapov naftalena šest ur na dan pet dni v tednu dve leti dolgo.[23] Raziskava je pri podganah obeh spolov dokazala rakotvornost naftalena. Pri obojih se je povečalo število adenomov in nevroblastomov v nosu. Pri mišjih samicah se je nekoliko povečalo število adenomov na pljučnih mešičkih in bronhijih, pri samcih pa niso dokazali nobenih znakov rakotvornosti.
Mednarodna agencija za raziskave raka (IARC) uvršča naftalen med možno rakotvorne snovi pri ljudeh, podganah, kuncih in miših. IARC tudi poudarja, da akutna izpostavljenost naftalenu povzroča razvoj sive mrene pri ljudeh, podganah, kuncih in miših, in da se že opisana hemolitična anemija lahko pojavi pri otrocih in dojenčkih po zaužitju ali vdihavanju ali preko matere med nosečnostjo.
Sklici
[uredi | uredi kodo]- ↑ 1,0 1,1 1,2 Ambient Water Quality Criteria for Naphthalene. United States Environmental Protection Agency|accessdate = 21. junija 2014}}
- ↑ 2,00 2,01 2,02 2,03 2,04 2,05 2,06 2,07 2,08 2,09 2,10 2,11 2,12 2,13 Lide, David R., ur. (2009). CRC Handbook of Chemistry and Physics (90. izd.). Boca Raton, Florida: CRC Press. ISBN 978-1-4200-9084-0.
- ↑ 3,0 3,1 3,2 Anatolievich, Kiper Ruslan. »naphthalene«. Химия и токсикология. Arhivirano iz prvotnega spletišča dne 22. decembra 2014. Pridobljeno 21. junija 2014.
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 Seidell, Atherton; Linke, William F. (1919). Solubilities of Inorganic and Organic Compounds (2. izd.). New York: D. Van Nostrand Company. str. 443–446.
- ↑ 5,0 5,1 P.J. Lindstrom, W.G. Mallard, urednika. Naphthalene. NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD. Pridobljeno 24. maja 2104.
- ↑ Thermal Conductivity of Naphthalene Arhivirano 2016-03-04 na Wayback Machine.. Pridobljeno 21. junija 2014.
- ↑ »Dynamic Viscosity of Naphthalene«. DDBST GmbH. Arhivirano iz prvotnega spletišča dne 4. marca 2016. Pridobljeno 21. junija 2014.
- ↑ 8,0 8,1 8,2 8,3 Douglas, Bodie E.; Ho, Shih-Ming (2007). Structure and Chemistry of Crystalline Solids. New York: Springer Science+Business Media, Inc. str. 288. ISBN 0-387-26147-8.
- ↑ 9,0 9,1 9,2 9,3 9,4 9,5 Sigma-Aldrich Co., Naphthalene. Pridobljeno 2014-06-21.
- ↑ J.E. Amoore, E. Hautala (1983). Odor as an aid to chemical safety: Odor thresholds compared with threshold limit values and volatiles for 214 industrial chemicals in air and water dilution. J Appl Toxicology 3 (6): 272–290. doi: 10.1002/jat.2550030603.
- ↑ E. Erlenmeyer (1866). Studien über die s. g. aromatischen Säuren. Annalen der Chemie und Pharmacie 137 (3): 327–359. doi: 10.1002/jlac.18661370309.
- ↑ 12,0 12,1 G. Collin, H. Höke, H. Greim (2003). Naphthalene and Hydronaphthalenes. Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. doi: 10.1002/14356007.a17_001.pub2.
- ↑ Termite 'mothball' keep insects at bay. April 2008.
- ↑ B.H. Daisy G.A. Strobel U. Castillo in drugi (november 2002). Naphthalene, an insect repellent, is produced by Muscodor vitigenus, a novel endophytic fungus[mrtva povezava]. Microbiology 148 (11): 3737–41. PMID 12427963.
- ↑ Interstellar Space Molecules That Help Form Basic Life Structures Identified. Science Daily. September 2008.
- ↑ S. Iglesias-Groth in drugi (2008). Evidence for the Naphthalene Cation in a Region of the Interstellar Medium with Anomalous Microwave Emission.. The Astrophysical Journal Letters 685: L55–L58, arXiv: 0809.0778, Bibcode: 2008ApJ...685L..55I. doi: 10.1086/592349.
- ↑ R. Hoover (2014). Need to Track Organic Nano-Particles Across the Universe? NASA's Got an App for That Arhivirano 2020-05-10 na Wayback Machine.. NASA. Pridobljeno 22. februarja 2014.
- ↑ Mothballs in Space. Astrobiology Magazine. Pridobljeno 25. decembra 2008.
- ↑ K. Komatsua, Y. Murataa, N. Sugitaa, K. Takeuchib, T.S.M. Wan (1993). Use of naphthalene as a solvent for selective formation of the 1:1 diels-alder adduct of C60 with anthracene. Tetrahedron Letter 34 (52): 8473–8476. doi: 10.1016/S0040-4039(00)61362-X.
- ↑ M.A. Filatov, A.V. Cheprakov (2011). The synthesis of new tetrabenzo- and tetranaphthoporphyrins via the addition reactions of 4,7-dihydroisoindole. Tetrahedron 67 (19): 3559–3566. doi: 10.1016/j.tet.2011.01.052.
- ↑ Naphthalene poisoning. MedlinePlus Encyclopedia.
- ↑ K. Santucci, B.Shah (2000). Association of naphthalene with acute hemolytic anemia. Acad Emerg Med. 7 (1): 42–47.
- ↑ NTP Technical Reports 410 and 500. Pridobljeno 6. marca 2005.