Diol


Un diol és un compost químic que conté dos grups hidroxils (grups—OH).[1] Aquest aparellament de grups funcionals és generalitzada i moltes subcategories han estat identificades. Els diols més comuns en la naturalesa són sucres i els seus polímers, de cel·lulosa. El diol industrial més comú és l'etilenglicol. Exemples de diols en què els grups funcionals hidroxil estan més àmpliament separats inclouen butan-1,4-diol HO—(CH₂)₄—OH i bisfenol A, i propilè-1,3-diol o beta propilen glicol, HO-CH₂-CH₂-CH₂-OH.
Classificació
[modifica]Diols geminals
[modifica]Un diol geminal té dos grups hidroxil enllaçats en el mateix àtom. Els exemples inclouen metanediol H₂C(OH)₂, la forma hidratada del formaldehid. Un altre exemple és (F₃C)₂C(OH)₂, la forma hidratada de l'hexafluoroacetona.
Diols vicinals
[modifica]En un diol vicinal, els dos grups hidroxil ocupen posicions vicinal, és a dir, estan units a àtoms adjacents. Aquestes conjuncions s'anomenen glicols.
Bis(fenol)s
[modifica]El bisfenol A és un compost important que conté dos grups fenol. Els fenols són alcohols aromàtics.
Síntesi
[modifica]Com que els diols són un arranjament comú de grups funcionals, s'han desenvolupat nombrosos mètodes de preparació.
- Els diols vicinals es poden produir de l'oxidació d'alquens.
- El tetraòxid d'osmi també es fa servir per oxidar alquens a diols vicinals.
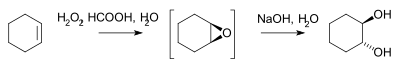
- El peròxid d'hidrogen reacciona amb un alquè a l'epòxid i després per la saponificació a diol.[2] o per microreactor:[3]
- Els diols germinals es poden formar per hidratació de les cetones.
Reaccions
[modifica]Diols generals
[modifica]Els diols reaccionen amb els alcohols, per esterificació i formació d'èter.
Un diol pot ser convertit en èter cíclic usant un àcid catalitzador, això és la ciclació del diol.

Diols vicinals
[modifica]En l'escissió del glicol, l'enllaç C-C en un diola vicinal s'escindeix amb la formació de grups funcionals de cetona o aldehid.
Diols geminals
[modifica]En general, els diols geminals orgànics ràpidament es deshidraten per formar un grup carbonil.
Referències
[modifica]- ↑ Plantilla:JerryMarch
- ↑ trans-cyclohexanediol Organic Syntheses, Coll. Vol. 3, p.217 (1955); Vol. 28, p.35 (1948) http://www.orgsynth.org/orgsyn/pdfs/CV3P0217.pdf.
- ↑ Advantages of Synthesizing trans-1,2-Cyclohexanediol in a Continuous Flow Microreactor over a Standard Glass Apparatus Andreas Hartung, Mark A. Keane, and Arno Kraft J. Org. Chem. 2007, 72, 10235-10238 doi:10.1021/jo701758p