Diol


Diol adalah suatu senyawa kimia yang mengandung dua gugus fungsional hidroksil (gugus −OH).[1] Penyandingan gugus fungsional ini meluas, dan banyak subkategori yang telah diidentifikasi. Diol yang paling umum dalam industri adalah etilen glikol. Contoh diol di mana gugus fungsional hidroksil lebih banyak dipisahkan meliputi 1,4-butanadiol HO−(CH2)4−OH dan bisfenol A, serta propilena-1,3-diol, atau beta propilen glikol, HO−CH2−CH2−CH2−OH.
Sintesis berbagai jenis diol
[sunting | sunting sumber]Diol geminal
[sunting | sunting sumber]Suatu diol geminal memiliki dua gugus hidroksil yang terikat pada atom yang sama. Spesi ini muncul dengan hidrasi senyawa karbonil. Hidrasi biasanya tidak menguntungkan, namun pengecualiannya adalah formaldehida yang, dalam air, berada dalam kesetimbangan dengan metanadiol. H2C(OH)2. Contoh lainnya adalah (F3C)2C(OH)2, bentuk hidrat dari heksafluoroaseton; dalam hal ini hidrasi dibuat menguntungkan oleh gugus penarik-elektron trifluorometil.
Diol visinal
[sunting | sunting sumber]Dalam sebuah diol visinal, dua gugus hidroksil menempati posisi visinal, yaitu melekat pada atom yang berdekatan. Senyawa ini disebut glikol. Contohnya meliputi 1,2-etanadiol atau etilena glikol HO−(CH2)2−OH, suatu bahan umum pada produk antibeku. Contoh lainnya adalah propana-1,2-diol, atau alfa propilena glikol, HO−CH2−CH(OH)−CH3, digunakan dalam industri makanan dan obat-obatan, serta produk antibeku yang relatif tidak beracun.
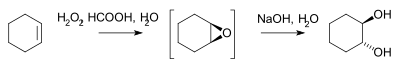
Pada skala komersial, rute utama bagi diola visinal adalah hidrolisis epoksida. Epoksida disiapkan dengan oksidasi alkena dengan hidrogen peroksida. Sebagai contoh dalam sintesis trans-sikloheksanadiol[2] atau oleh mikroreaktor:[3]
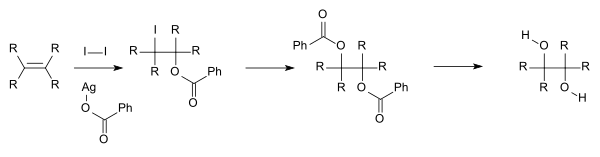
Untuk penelitian akademis dan bidang farmasi, diol visinal sering diproduksi dari oksidasi alkena, biasanya dengan asam encer kalium permanganat. Menggunakan alkali kalium manganat(VII) menghasilkan perubahan warna dari ungu dalam yang jernih menjadi hijau jernih; asam kalium manganat (VII) ternyata tidak berwarna. Osmium tetroksida juga bisa digunakan untuk mengoksidasi alkena menjadi diol visinal. Reaksi kimia yang disebut dihidroksilasi asimetris Sharpless dapat digunakan untuk menghasilkan diol kiral dari alkena yang menggunakan pereaksi osmat dan katalis kiral. Metode lain adalah cis-hidroksilasi Woodward (cis diol) dan reaksi Prévost yang terkait (anti diol), yang digambarkan di bawah, yang keduanya menggunakan iodin dan garam perak dari asam karboksilat.
1,3-Diol
[sunting | sunting sumber]1,3-Diol sering disiapkan secara industri dengan kondensasi aldol keton dengan formaldehida. Karbonil yang dihasilkan direduksi dengan menggunakan reaksi Cannizzaro atau dengan katalis hidrogenasi:
- RC(O)CH3 + CH2O → RC(O)CH2CH2OH
- RC(O)CH2CH2OH + H2 → RCH(OH)CH2CH2OH
2.2-Disubstitusi propana-1,3-diol dibuat dengan cara ini. Contohnya termasuk 2-metil-2-propil-1,3-propanadiol dan neopentil glikol.
1,3-Diol dapat dibuat dengan hidrasi α, β-keton tak jenuh dan aldehida. Keto-alkohol yang dihasilkan terhidrogenasi. Rute lainnya melibatkan hidroformilasi epoksida yang diikuti dengan hidrogenasi aldehida. Metode ini telah digunakan untuk memproduksi 1,3-propanadiol dari etilen oksida.
Rute yang lebih khusus bagi 1,3-diol melibatkan reaksi antara alkena dan formaldehida, reaksi Prins. 1,3-diol dapat diproduksi secara diastereoselektif dari β-hidroksi keton yang sesuai dengan protokol reduksi Evans–Saksena, Narasaka–Prasad atau Evans–Tishchenko.
1,4-, 1,5-, dan diol yang lebih panjang
[sunting | sunting sumber]Diol di mana gugus alkohol dipisahkan oleh beberapa pusat karbon umumnya dibuat dengan hidrogenasi diester dari asam dikarboksilat yang sesuai.[4] 1,4-butanadiol dan 1,5-pentanadiol merupakan prekursor penting bagi poliuretan.
- (CH2)n(CO2H)2 + 4 H2 → (CH2)n(CH2OH)2 + 2 H2O
Bisfenol A adalah senyawa penting yang mengandung dua gugus fenol. Senyawa ini adalah blok pembangun dalam produksi plastik polikarbonat. Senyawa ini dihasilkan oleh kondensasi fenol dan aseton.
Reaksi
[sunting | sunting sumber]Dari perspektif industri, reaksi diol yang dominan adalah dalam produksi poliuretan dan resin alkid.[4]
Diol umum
[sunting | sunting sumber]Diol bereaksi seperti alkohol, melalui esterifikasi dan pembentukan eter.
Diol seperti etilen glikol digunakan sebagai reaksi ko-monomer dalam polimerisasi yang membentuk polimer termasuk beberapa poliester dan poliuretan. Monomer yang berbeda dengan dua gugus fungsional identik, seperti dioil diklorida atau asam dioat diperlukan untuk melanjutkan proses polimerisasi melalui proses esterifikasi berulang.
Diol dapat dikonversi menjadi eter siklik dengan menggunakan katalis asam, hal ini adalah siklisasi diol. Pertama, reaksi ini melibatkan protonasi gugus hidroksil. Kemudian, diikuti substitusi nukleofilik intramolekuler, gugus hidroksil kedua menyerang karbon yang kekurangan elektron. Apabila ada cukup banyak atom karbon yang regangan sudutnya tidak terlalu banyak, eter siklik dapat terbentuk.
Diol juga dapat dikonversi menjadi lakton yang menggunakan reaksi oksidasi Fétizon.
Diol visinal
[sunting | sunting sumber]Dalam pembelahan glikol, ikatan C-C di dalam diol visinal dibelah dengan pembentukan gugus fungsional keton atau aldehida. Lihat oksidasi diol.
Diol geminal
[sunting | sunting sumber]Secara umum, diol geminal organik mudah terdehidrasi membentuk gugus karbonil. Misalnya, asam karbonat ((HO)2C=O) tidak stabil dan memiliki tendensi untuk berubah menjadi karbon dioksida (CO2) dan air (H2O). Namun demikian, dalam situasi yang jarang kesetimbangan kimia lebih condong berada pada diol geminal. Sebagai contoh, ketika formaldehida (H2C=O) dilarutkan dalam air, diol geminal (H2C(OH)2, metanadiol) lebih disukai. Contoh lainnya adalah diol geminal siklik dekahidroksisiklopentana (C5(OH)10) dan dodekahidroksisikloheksana (C6(OH)12), yang bersifat stabil, sementara oksokarbon terkait (C5O5 and C6O6) tidak stabil.
Lihat pula
[sunting | sunting sumber]- Alkohol, senyawa kimia dengan setidaknya satu gugus hidroksil
- Triol, senyawa kimia dengan tiga gugus hidroksil
- Poliol, senyawa kimia dengan banyak gugus hidroksil
- Etilen glikol
- Asam nukleat glikol (GNA)
Referensi
[sunting | sunting sumber]- ^ March, Jerry (1985). Advanced Organic Chemistry, Reactions, Mechanisms and Structure (dalam bahasa Inggris) (edisi ke-3). John Wiley & Sons. ISBN 0-471-85472-7.
- ^ trans-cyclohexanediol Organic Syntheses, Coll. Vol. 3, p.217 (1955); Vol. 28, p.35 (1948) http://www.orgsynth.org/orgsyn/pdfs/CV3P0217.pdf.
- ^ Advantages of Synthesizing trans-1,2-Cyclohexanediol in a Continuous Flow Microreactor over a Standard Glass Apparatus Andreas Hartung, Mark A. Keane, and Arno Kraft J. Org. Chem. 2007, 72, 10235-10238 doi:10.1021/jo701758p
- ^ a b Peter Werle, Marcus Morawietz, Stefan Lundmark, Kent Sörensen, Esko Karvinen and Juha Lehtonen "Alcohols, Polyhydric" Ullmann's Encyclopedia of Industrial Chemistry, 2008, Wiley-VCH, Weinheim. doi:10.1002/14356007.a01_305.pub2