Tetralin
| Tetralin | |
|---|---|
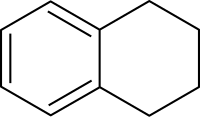 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | 1,2,3,4-tetrahydronaftalen |
| Sumární vzorec | C10H12 |
| Vzhled | bezbarvá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 119-64-2 |
| EC-no (EINECS/ELINCS/NLP) | 204-340-2 |
| PubChem | 8404 |
| ChEBI | 35008 |
| SMILES | C1CCC2=CC=CC=C2C1 |
| InChI | InChI=1S/C10H12/c1-2-6-10-8-4-3-7-9(10)5-1/h1-2,5-6H,3-4,7-8H2 |
| Číslo RTECS | QK3850000 |
| Vlastnosti | |
| Molární hmotnost | 132,20 g/mol |
| Teplota tání | −35,8 °C (237,4 K)[1] |
| Teplota varu | 207,6 °C (480,8 K)[1] |
| Hustota | 0,9702 g/cm3 (20 °C)[1] |
| Rozpustnost ve vodě | téměř nerozpustný[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v acetonu, anilinu, methanolu, ethanolu, butan-1-olu a chloroformu[1] |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v benzenu a diethyletheru[1] |
| Tlak páry | 0,05 kPa[1] |
| Bezpečnost | |
| [1] | |
| H-věty | H315, H319, H411[1] |
| P-věty | P264, P264+265, P273, P280, P302+352, P305+351+338, P321, P332+317, P337+317, P362+364, P391, P501[1] |
| Teplota vzplanutí | 82 °C (355 K)[1] |
Některá data mohou pocházet z datové položky. | |
Tetralin (1,2,3,4-tetrahydronaftalen) je uhlovodík se vzorcem C10H12, odvozený od naftalenu jeho částečnou hydrogenací. Tato bezbarvá kapalina se používá jako rozpouštědlo dodávající vodík.[2]
Výroba a příprava
[editovat | editovat zdroj]Tetralin se vyrábí katalytickou hydrogenací naftalenu.[2]
Při této hydrogenaci lze použít více různých katalyzátorů, nejčastější jsou ty založené na niklu.[3]
Další hydrogenací tetralinu se tvoří dekahydronaftalen (dekalin). Ojediněle může vznikat také 1,2-dihydronaftalen (dialin).
Laboratorní příprava
[editovat | editovat zdroj]Tetralin lze získat Darzensovou syntézou, která spočívá ve vnitromolekulární elektrofilní aromatické substituční reakci 1-aryl-pent-4-enu za přítomnosti koncentrované kyseliny sírové,[4]

Použití
[editovat | editovat zdroj]Tetralin slouží jako rozpouštědlo dodávající vodík, a to například ve výrobě syntetického benzinu; molekuly H2 hydrogenují uhlí, vzniklý produkt je poté lépe rozpustný.[5][2]
Tato látka se také používá v rychlých reaktorech chlazených sodíkem jako sekundární chladivo, které udržuje sodík v pevném skupenství; z velké části byla ale nahrazena NaK.[6]:s.24:30
Tetralin je také výchozí látkou při laboratorní přípravě bromovodíku:
- C10H12 + 4 Br2 → C10H8Br4 + 4 HBr
Bezpečnost
[editovat | editovat zdroj]Tetralin vyvolává methemoglobinémii.[2] LD50 (u krys, při ústním podání) činí 2,68 g/kg.
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Tetralin na anglické Wikipedii.
- ↑ a b c d e f g h i j k l https://pubchem.ncbi.nlm.nih.gov/compound/8404
- ↑ a b c d COLLIN, Gerd; HÖKE, Hartmut; GREIM, Helmut. Naphthalene and Hydronaphthalenes. Příprava vydání Wiley-VCH Verlag GmbH & Co. KGaA. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA Dostupné online. ISBN 978-3-527-30673-2. DOI 10.1002/14356007.a17_001.pub2. S. a17_001.pub2. (anglicky) DOI: 10.1002/14356007.a17_001.pub2.
- ↑ A. A. Krichko; D. V. Skvortsov; T. A. Titova; B. S. Filippov; N. E. Dogadkina. Production of tetralin by the hydrogenation of naphthalene-containing fractions. Chemistry and Technology of Fuels and Oils. 1969, s. 18–22. DOI 10.1007/BF00727949.
- ↑ Michael B. Smith. Organic Synthesis. [s.l.]: Academic Press, 2011. ISBN 9780124158849.
- ↑ Khairuddin M. Isa, Abdullah, Tuan Amran Tuan; Md. Ali, Umi Fazara. Hydrogen donor solvents in liquefaction of biomass: A review. Renewable and Sustainable Energy Reviews. 2018, s. 1259–1268. DOI 10.1016/j.rser.2017.04.006.
- ↑ US Atomic Energy Commission (1961) SRE Core Recovery.
Související články
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Tetralin na Wikimedia Commons
Obrázky, zvuky či videa k tématu Tetralin na Wikimedia Commons



