Kalia dukromiato
| Kalia dukromiato | |||||
 | |||||
| Plata kemia strukturo de la Kalia dukromiato | |||||
 | |||||
| Tridimensia kemia strukturo de la Kalia dukromiato | |||||
 | |||||
| Kristala strukturo de la Kalia dukromiato | |||||
 | |||||
| Ruĝaj kristaloj de Kalia dukromiato | |||||
| Alternativa(j) nomo(j) | |||||
| |||||
| Kemia formulo | |||||
| CAS-numero-kodo | 7778-50-9 | ||||
| ChemSpider kodo | 22910 | ||||
| PubChem-kodo | 24502 | ||||
| Merck Index | 15,7748 | ||||
| Fizikaj proprecoj | |||||
| Aspekto | oranĝokolora senodora solidaĵo | ||||
| Molmaso | 294182 g·mol-1 | ||||
| Denseco | 2.676g cm−3 | ||||
| Fandpunkto | 398 °C | ||||
| Bolpunkto | 500 °C | ||||
| Refrakta indico | 1,738 | ||||
| Solvebleco | Akvo:115 g/L [1] | ||||
| Mortiga dozo (LD50) | 90,5 mg/kg (buŝe) | ||||
| Sekurecaj Indikoj | |||||
| Riskoj | R45 R46 R60 R61 R21 R25 R26 R48/23 R8 R34 R42/43 R50/53 | ||||
| Sekureco | S53 S45 S60 S61 | ||||
| Pridanĝeraj indikoj | |||||
| Danĝero
| |||||
| GHS Damaĝo Piktogramo |
| ||||
| GHS Signalvorto | Damaĝa substanco | ||||
| GHS Deklaroj pri damaĝoj | H272, H301, H312, H314, H317, H318, H330, H334, H340, H350, H360, H372, H373, H400 | ||||
| GHS Deklaroj pri antaŭgardoj | P201, P202, P210, P220, P221, P260, P261, P264, P270, P271, P272, P273, P280, P281, P284, P301+310, P301+330+331, P302+352, P303+361+353, P304+340, P304+341, P305+351+338, P308+313, P310, P312, P314, P320, P330, P333+313, P342+311[2] | ||||
(25 °C kaj 100 kPa) | |||||
Kalia dukromiato aŭ K2Cr2O7, estas neorganika kemia reakcianto, tre ofte uzata kiel oksidilo en pluraj laboratoriaj kaj industriaj aplikadoj. Kiel la heksavalentaj kromikomponaĵoj, tiel ĝi estas akre kaj kronike danĝera por la homa sano. Ĝi aspektas kiel kristaleca solidaĵo alte brila kaj intensa ruĝo-duonoranĝa koloro. La salo estas populara en la laboratorioj ĉar ĝi ne estas solvebla, kontraste kun la plej industrie grava salo Natria dukromiato. Ĝi estas solvebla en akvo kaj alkoholo, uzatas en la produktiĝo de kolorigiloj, en elektrogalvanizado, pirotekniko, kaj manufakturo de vitroj, gluaĵoj, tanado, litografio kaj aliaj ceramikaĵoj.
Sekureco
[redakti | redakti fonton]La dukromiato de kalio estas danĝera substanco. Ĝi povas esti fatala se absorbita de la haŭto, ingestita aŭ inhalita. Ĝi entenas heksavalentan kromion, kiu estas kancerogena por la homoj, krom prezenti sin kiel okula kaj spiraparata iritilo. Pro ĝia kanceriga karaktero, ĝi uzatas en laboratoriaj testoj, kie mortigaj substancoj aplikiĝas por fari komparojn kun aliaj samkarakteraj komponaĵoj. Ĝi estas alte danĝera en fajro-kazo pro ties oksidaj proprecoj, do, ĝi devas konserviĝi for de bruligeblaĵoj. Ĝi ankaŭ uzatas en laboratoriaj eksperimentoj (ekzemple: por eksplodatipa vulkansimulado) kaj oni ĉiam devas uzi protektilaron same kiel gantoj, kiteloj kaj vizaĝomasko por sekureco de la spirvojaro.
Reakcioj
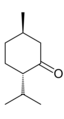
[redakti | redakti fonton]Kalia dukromiato estas potenca oksidilo en organika kemio, kaj agas pli milde ol la kalia permanganato. Ĝi uzatas por oksidi la alkoholojn, transformante primarajn alkoholojn en aldehidojn kaj, sub plej drastaj kondiĉoj, en karboksilatajn acidojn. Kontraŭe, uzante permanganaton la solaj produktoj akireblaj estas la nur karboksilataj acidoj. Sekundaraj alkoholoj transformiĝas en ketonon. Ekzemple: mentono eblas prepariĝi pere de oksidado de la mentolo kun dukromiato en acida medio. Terciaraj alkoholoj ne oksideblas per dukromiato de kalio.
En akva solvaĵo la ŝanĝokoloro elmontrita estas uzebla por distingi la aldehidojn el la ketonoj. Aldehidoj reduktas la dukromiaton el heksavalenta (+6) oksidastato al trivalenta (+3), ŝanĝante la koloron el oranĝa al verda. Ĉi-kolorŝanĝo okazas ĉar la aldehidoj estas oksideblaj al la kunresponda karboksilata acido. La ketono ne elmontras ŝanĝokoloron ĉar ĝi ne permesas pluan oksidadon, do, la solvaĵo restas oranĝokolora.
Kiam forte varmigita, ĝi malkomponiĝas kun oksigenliberigo.
4K2Cr2O7 → 4K2CrO4 + 2Cr2O3 + 3O2
Kiam iu alkalo aldoniĝas al iu ruĝo-oranĝokoloreca solvaĵo entenanta dukromiatajn jonojn (Cr2O7−2), flava solvaĵo akiriĝas pro la formiĝo de kromiataj jonoj (CrO4−2). Ekzemple: kalia kromiato industrie produktiĝas uzante Kalian karbonaton.
K2Cr2O7 + K2CO3 → 2 K2CrO4 + CO2
La reakcio estas returnebla.
Traktado kun Sulfata acido akiras ruĝaj kristaloj je kromiata anhidrido (CrO3):
K2Cr2O7 + 2H2SO4 → 2CrO3 + 2 KHSO4 + H2O
Kiam varmigita kun koncentrita acido, la oksigeno liberiĝas:
2 K2Cr2O7 + 8H2SO4 → 2 K2SO4 + 2 Cr2(SO4)3 + 8 H2O + 3O2
Alkohola determino
[redakti | redakti fonton]La alkohola koncentriĝo en specimeno estas determinebla per returnebla titrado medie de kalia dukromiato. Reakciante la specimenon kun la eksceso de kalia dukromiato, la tuta alkoholo oksidiĝas al acetata acido:
CH3CH2OH + 2[O] → CH3COOH + H2O
La dukromiata eksceso determineblas per titrado kun natria tiosulfato. Deduktante la kvanton de la ekscesa dukromiato el la komenca reakcio, oni determinas la ĉeestantan alkoholon. Akurateco estas plibonigebla komparante la dukromiatan solvaĵon kun iu blanka specimeno. La ĉefa uzo de ĉi-reakcio kuŝas en la malnovaj spiranaliziloj uzataj de la policistoj. Kiam la alkohola vaporo ekkontaktas kun la oranĝokoloraj dukromiataj kristaloj, la koloro ŝanĝas el oranĝa al verda. La grado de la kolorŝanĝo rekte rilatas al la alkoholnivelo en la spirado de la suspektito.
La ĉefa uzo de la dukromiato de kalio en industrio estas kiel antaŭanto de la kalia kaj kromia aluno, uzata en leda tanado.
Referencoj
[redakti | redakti fonton]Vidu ankaŭ
[redakti | redakti fonton]
| ||||||