Acid glioxilic
| Acid glioxilic | |
 | |
 | |
| Nume IUPAC | Acid oxoacetic[1] |
|---|---|
| Identificare | |
| Număr CAS | 298-12-4 |
| ChEMBL | CHEMBL1162545 |
| PubChem CID | 760 |
| Formulă chimică | C₂H₂O₃[2] |
| Masă molară | 74 u.a.m.[3] |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Acidul glioxilic sau acidul oxoacetic[1] este un compus organic de tip acid carboxilic. Este un solid incolor. Derivații acestuia se numesc glioxilați.
Structură
[modificare | modificare sursă]Acidul glioxilic conține o grupă aldehidică, însă compusul există de obicei sub formă de dimer ciclic sau de hidrat. În prezența apei, grupa carbonilică se convertește la un diol geminal (forma monohidratată), mai exact la acidul dihidroxiacetic, iar constanta de echilibru pentru formarea acestui acid în condiții normale are valoare K=300:[4]
În soluție, forma monohidratată coexistă în echilibru cu forma de dimer hemiacetalic:[5]
În formă pură, compusul prezintă un conformer majoritar cu structură ciclică, în care grupa aldehidă se află în apropierea hidrogenului din grupa carboxil, iar în stabilitatea structurii sunt implicate legături de hidrogen:[6]
Producere
[modificare | modificare sursă]Acidul glioxilic a fost obținut pentru prima dată în urma electrolizei acidului oxalic:[7][8] se utilizau catozi de dioxid de plumb și acid sulfuric ca electrolit.[9]
De asemenea, este eficientă și metoda de ozonoliză a acidului maleic.[5]
Proprietăți
[modificare | modificare sursă]Aciditate
[modificare | modificare sursă]Acidul glioxilic este un acid mai tare decât acidul acetic, având o constantă de disociere de 4,7 * 10−4 (pKa = 3,32); prin ionizare, formează ionul glioxilat:
Derivați fenolici
[modificare | modificare sursă]Acidul glioxilic suferă reacții de substituție electrofilă aromatică cu fenolii, care pot fi utilizate în sinteza organică. Prin reacția cu fenolul se obține acidul 4-hidroximandelic, care în reacția cu amoniacul produce hidroxifenilglicina (un precursor pentru amoxicilină). Prin reducere, acidul 4-hidroximandelic formează acidul 4-hidroxifenilacetic, care este un precursor pentru atenolol.
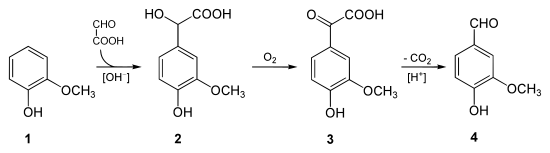
În același mod se poate obține și vanilina (și etilvanilina), plecând de la acidul glioxilic și guaiacol, urmată de reacții de oxidare și de decarboxilare. Acesta este un exemplu de reacție de formilare:[5][10][11]
Pentru sinteza etilvanilinei se pleacă de la guaetol:[12]
Note
[modificare | modificare sursă]- ^ a b „Front Matter”. Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. . p. 748. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ a b „Acid glioxilic”, glyoxylic acid (în engleză), PubChem, accesat în
- ^ „Acid glioxilic”, glyoxylic acid (în engleză), PubChem, accesat în
- ^ Sørensen, P. E.; Bruhn, K.; Lindeløv, F. (). „Kinetics and equilibria for the reversible hydration of the aldehyde group in glyoxylic acid”. Acta Chem. Scand. 28: 162–168. doi:10.3891/acta.chem.scand.28a-0162.
- ^ a b c Georges Mattioda, Yani Christidis: “Glyoxylic Acid” din Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a12_495
- ^ Redington, Richard L.; Liang, Chin-Kang Jim (). „Vibrational spectra of glyoxylic acid monomers”. Journal of Molecular Spectroscopy. 104 (1): 25–39. Bibcode:1984JMoSp.104...25R. doi:10.1016/0022-2852(84)90242-X.
- ^ Tafel, Julius; Friedrichs, Gustav (). „Elektrolytische Reduction von Carbonsäuren und Carbonsäureestern in schwefelsaurer Lösung”. Berichte der Deutschen Chemischen Gesellschaft. 37 (3): 3187–3191. doi:10.1002/cber.190403703116.
- ^ Cohen, Julius (). Practical Organic Chemistry 2nd Ed (PDF). London: Macmillan and Co. Limited. pp. 102–104.
- ^ François Cardarelli (). Materials Handbook: A Concise Desktop Reference. Springer. p. 574. ISBN 978-1-84628-668-1.
- ^ Fatiadi, Alexander; Schaffer, Robert (). „An Improved Procedure for Synthesis of DL-4-Hydroxy-3-methoxymandelic Acid (DL-"Vanillyl"-mandelic Acid, VMA)”. Journal of Research of the National Bureau of Standards Section A. 78A (3): 411–412. doi:10.6028/jres.078A.024.
- ^ Kamlet, Jonas; Mathieson, Olin (). Manufacture of vanillin and its homologues U.S. Patent 2,640,083 (PDF). U.S. Patent Office.
- ^ Karl-Georg Fahlbusch, Franz-Josef Hammerschmidt, Johannes Panten, Wilhelm Pickenhagen, Dietmar Schatkowski, Kurt Bauer, Dorothea Garbe, Horst Surburg "Flavors and Fragrances" din Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim: 2002. Published online: 15 January 2003; doi:10.1002/14356007.a11_141.
Vezi și
[modificare | modificare sursă]
| ||||||||