Peroxide
Bài viết hoặc đoạn này cần được wiki hóa để đáp ứng tiêu chuẩn quy cách định dạng và văn phong của Wikipedia. |
Bài viết này cần thêm chú thích nguồn gốc để kiểm chứng thông tin. |

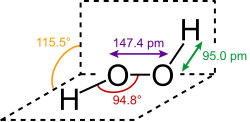
Peroxide là hợp chất với cấu trúc R-O-O-R.[1] Nhóm O-O trong peroxide được gọi là nhóm peroxide hoặc nhóm peroxo. Trái với các ion oxide, các nguyên tử oxy trong ion peroxide có trạng thái oxy hóa (số oxi hoá) là -1.
Peroxide ổn định đơn giản nhất là hydro peroxide. Nó được bán ra dưới dạng dung dịch nước với các nồng độ khác nhau. Hydro peroxide là chất lỏng trong suốt có màu lam rất nhạt nhưng các dung dịch nước của nó thì không màu. Nó chủ yếu được sử dụng làm chất oxy hóa và chất tẩy trắng. Tuy nhiên, hydro peroxide cũng được sản xuất trong cơ thể con người bằng phương pháp hóa sinh học, chủ yếu như là kết quả từ hoạt động của một loạt các enzym oxidase.[2] Các dung dịch đậm đặc có tiềm năng gây nguy hiểm khi cho tiếp xúc với các hợp chất hữu cơ.
Ngoài hydro peroxide, còn một số lớp peroxide chính như:
- Acid peroxy, các dẫn xuất peroxy của nhiều acid thông thường, như acid peroxymonosulfuric và acid peracetic.
- Peroxide kim loại, như bari peroxide (BaO2) và natri peroxide (Na2O2).
- Peroxide hữu cơ, các hợp chất với công thức R1-O-O-R2. Ví dụ như tert-butylhydroperoxide
- Peroxide nhóm chính, các hợp chất với liên kết E-O-O-E (E = nguyên tố nhóm chính), ví dụ như kali peroxydisulfat (K2S2O8).
Các hợp chất peroxide có thể được phân loại thô thành chất hữu cơ và vô cơ. Trong khi các peroxide vô cơ có tính chất ion, muối, các peroxide hữu cơ bị chi phối bởi các liên kết đồng hóa trị. Các liên kết hóa học oxy-oxy của peroxide là không ổn định và dễ dàng chia thành các gốc phản ứng thông qua sự phân chia homolytic. Vì lý do này, peroxide được tìm thấy trong tự nhiên chỉ với số lượng nhỏ, trong nước, bầu khí quyển, thực vật và động vật. Sự hình thành ion peroxide gần đây đã được nhấn mạnh là một trong những cơ chế chính để các oxide chứa oxy dư thừa trong tinh thể ion và có thể có ảnh hưởng lớn đến một loạt các ứng dụng công nghiệp bao gồm các pin nhiên liệu oxide rắn.
Peroxide có hiệu ứng tẩy trắng đối với các chất hữu cơ và do đó được thêm vào một số chất tẩy rửa và chất làm tóc. Các ứng dụng quy mô lớn khác bao gồm y học và công nghiệp hóa học, nơi peroxide được sử dụng trong các phản ứng tổng hợp khác nhau hoặc xảy ra như các sản phẩm trung gian. Với sản lượng hàng năm trên 2 triệu tấn, hydro peroxide là peroxide quan trọng nhất về mặt kinh tế. Nhiều peroxide là các chất không ổn định và nguy hiểm; chúng không thể được lưu trữ và do đó được tổng hợp tại chỗ và sử dụng ngay lập tức.
Các superoxide, dioxygenyl, ozon và ozonit được xem xét riêng.
Tham khảo
[sửa | sửa mã nguồn]- ^ IUPAC. Peroxides. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught & A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). XML on-line corrected version: http://goldbook.iupac.org (2006-) created by M. Nic, J. Jirat, B. Kosata; updates compiled by A. Jenkins. ISBN 0967855098. doi:10.1351/goldbook.P04510.
- ^ Halliwell, Barry; Clement, Marie Veronique; Long, Lee Hua (2000). “Hydrogen peroxide in the human body”. FEBS Letters. 486 (1): 10–3. doi:10.1016/S0014-5793(00)02197-9. PMID 11108833.