Kyselina vinná
| Kyselina vinná | |
|---|---|
 | |
 Vzhled | |
| Obecné | |
| Systematický název | 2,3-dihydroxybutandiová kyselina |
| Triviální název | kyselina vinná |
| Ostatní názvy | 2,3-dihydroxyjantarová kyselina |
| Latinský název | acidum tartaricum |
| Anglický název | tartaric acid |
| Německý název | Weinsäure |
| Funkční vzorec | HOOCCH(OH)CH(OH)COOH |
| Sumární vzorec | C4H6O6 |
| Vzhled | bílý prášek |
| Identifikace | |
| Registrační číslo CAS | 87-69-4 (L(+)) 147-71-7 (D(−)) 147-73-9 (meso-forma)&Units=SI 526-83-0 87-69-4 (L(+)) 147-71-7 (D(−)) 147-73-9 (meso-forma) |
| Vlastnosti | |
| Molární hmotnost | 150,087 g/mol |
| Teplota tání | 169–170 °C (opticky aktivní) 142 °C (meso-forma) 206 °C (racemát) |
| Hustota | 1,759 8 g/cm³ (opticky aktivní) 1,666 g/cm³ (meso-forma) 1,788 g/cm³ (racemát) |
| Rozpustnost ve vodě | 133 g/100 ml (20 °C) |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
Některá data mohou pocházet z datové položky. | |
Kyselina vinná (2,3-dihydroxybutandiová kyselina, kyselina dihydroxyjantarová, latinsky acidum tartaricum z řeckého tartaros – peklo, název kvůli hořlavosti a korozivním účinkům). Funkční vzorec je HOOC–CH(OH)–CH(OH)–COOH. Kyselina vinná je bezbarvá krystalická látka, dobře rozpustná ve vodě, kyselé chuti. Její soli se nazývají vinany.

Kyselina vinná byla vinařům známa po staletí. Již kolem roku 800 byla alchymistou Jabir ibn Hayyanem izolována ze své soli hydrogenvinanu draselného (vinný kámen). Ale až v roce 1769 vyvinul švédský chemik Carl Wilhelm Scheele proces pro její extrakci.
Tato přirozeně se vyskytující krystalická organická kyselina se nachází v mnoha druzích ovoce, zejména ve vinné révě, ale také v banánech, tamarindech a citrusech.
Její sůl hydrogenvinan draselný vzniká při výrobě vína. Kyselina vinná je proto jednou z hlavních kyselin ve víně, které určují její senzorické i další vlastnosti. V EU je schválena jako potravinářská přídatná látka E 334.
Chiralita
[editovat | editovat zdroj]
Historie
[editovat | editovat zdroj]Důležitou roli při objevu chemické chirality hrála právě kyselina vinná. Tato její vlastnost byla poprvé pozorována v roce 1832 Jean-Baptiste Biotem, který objevil její schopnost otáčet polarizovaným světlem. V tomto výzkumu pokračoval Louis Pasteur a v roce 1847 zjistil, že krystaly vinanu sodno-amonného jsou také chirální. Při ručním tříděním různě tvarovaných krystalů Pasteur jako první vyrobil čistý vzorek kyseliny levovinné.

Optická aktivita
[editovat | editovat zdroj]- Optická aktivita souvisí s vnitřním prostorovým uspořádáním atomů v molekule.
- Opticky aktivní látky stáčejí rovinu polarizovaného monochromatického záření doleva nebo doprava.
- Nejčastějšími opticky aktivními látkami jsou organické sloučeniny uhlíku.
Chirální molekuly
[editovat | editovat zdroj]- Chirální molekuly obsahují asymetrický atom, který se nazývá chirální centrum molekuly. Dvojice takových molekul se k sobě chovají jako předmět a jeho obraz v zrcadle (nebo jako levá a pravá ruka). Tato jejich vlastnost se nazývá chiralita (z řeckého chiros, česky ruka nebo dlaň).
- Centrum chirality je atom, na který jsou ostatní atomy navázány zrcadlově asymetricky. Většinou se jedná o atom uhlíku se čtyřmi různými substituenty. Takový atom uhlíku se nazývá asymetrický uhlík.

Optické izomery
[editovat | editovat zdroj]Dvojice látek, které obsahují asymetrický uhlík a vyskytují se ve dvou formách (předmět - obraz), se nazývají optické izomery (enantiomery nebo optické antipody).
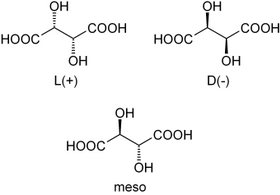
Příkladem takové opticky aktivní látky je kyselina vinná, která se vyskytuje ve třech optických izomerech:
- L-vinná kyselina (konfiguračně L-, opticky pravotočivá, odtud starší název kyselina pravovinná)
- D-vinná kyselina (Konfiguračně D-, opticky levotočivá, odtud starší název kyselina levovinná)
- meso-vinná kyselina (achirální sloučenina, která není opticky aktivní)
Směs stejných množství pravotočivé a levotočivé látky vytváří opticky neaktivní látku (racemát), která polarizační rovinu nestáčí. Právě takovou látkou je opticky neaktivní kyselina hroznová, což je směs stejných množství pravotočivé a levotočivé kyseliny vinné (molekuly kyseliny levovinné a pravovinné jsou svými zrcadlovými obrazy).
Výskyt
[editovat | editovat zdroj]V přírodě je nejvíce rozšířena L-vinná kyselina a racemická kyselina vinná neboli kyselina hroznová. Je obsažena například ve vinných hroznech, ananasu, banánech, tamarindech a citrusech.
Kyselina vinná se obvykle získává jako vedlejší produkt z hroznů při výrobě vína. Při tomto procesu se k vinanu draselnému postupně přidává hydroxid sodný, poté kyselina sírová za vzniku kyseliny vinné.
Použití
[editovat | editovat zdroj]- Kyselina vinná se používá především k úpravě kyselosti ovocných nápojů, vín, cukrovinek, želé, pekařských výrobků, ovocných šťáv, mražených mléčných výrobků.
- Je složkou některých potravinářských barviv.
- Jako kyselá složka je součástí prášku do pečiva,
- Používá se jako emulgátor regulující proces rosolovatění nebo jako zvlhčující látka.
- Má vlastnost vázat železnaté a měďnaté ionty, které katalyzují samovolnou oxidaci tuků, a tím může zabraňovat procesu žluknutí.
- Z kyseliny vinné je odvozen vinan sodno-draselný neboli Seignettova sůl KOOCCH(OH)CH(OH)COONa, která je součástí Fehlingova činidla sloužícího k důkazu redukujících sacharidů.
- Mezi důležité deriváty kyseliny vinné patří emetikum (vinan draselno-antimonitý, při vyšších dávkách dávidlo).
Nežádoucí účinky
[editovat | editovat zdroj]Nejsou známy nežádoucí účinky kyseliny vinné, je považována za bezpečnou látku. V potravinách se vyskytuje jako přirozená složka. Ve velkém množství však může mít projímavé účinky nebo může způsobit zánět žaludku a střev. D-forma kyseliny vinné může při vylučování způsobit vznik a růst krystalů. Přijatelná denní dávka je 0-30 mg/kg tělesné hmotnosti.
Reference
[editovat | editovat zdroj]V tomto článku byly použity překlady textů z článků Tartaric acid na anglické Wikipedii a Weinsäure na německé Wikipedii.
- ↑ a b Tartaric acid. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu kyselina vinná na Wikimedia Commons
Obrázky, zvuky či videa k tématu kyselina vinná na Wikimedia Commons  Encyklopedické heslo Vinná kyselina v Ottově slovníku naučném ve Wikizdrojích
Encyklopedické heslo Vinná kyselina v Ottově slovníku naučném ve Wikizdrojích- Seznam děl v Souborném katalogu ČR, jejichž tématem je Kyselina vinná


